
在隔绝空气的条件下,某同学将一块被氧化钠覆盖的钠块用一张刺有小孔的纯净铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待反应完全后,在容器中收集到1.12 L H2(标准状况,忽略溶解的氢气的量),测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol·L-1。 试通过计算确定该钠块中钠元素的质量分数(精确到0.1%)。
(9分)88.8%.
由反应:Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑,
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑………………………….………...(1分)
则:n(余NaOH) = 2.0 L×0.05 mol·L-1 = 0.1 mol........................................(1分)
n(H2) =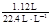 =0.05 mol.......................................................................(1分)
=0.05 mol.......................................................................(1分)
n(Al) = n(NaAlO2)= = 0.01 mol.............................................(1分)
= 0.01 mol.............................................(1分)
由电子守恒知:n(Na)+3n(Al) = 2n(H2)
即:n(Na)+3×0.01 mol = 2×0.05 mol,得:n(Na) = 0.07 mol…………..…(1分)
由钠守恒知:n(NaAlO2)+n(NaOH) = n(Na)+2n(Na2O)
即:0.01 mol+0.1 mol = 0.07 mol+2n(Na2O)........................................….…(1分)
得:n(Na2O) = 0.02 mol…………………………………..…………………….(1分)
w (Na) =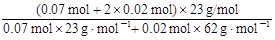 ×100%≈88.8%...................
(2分)
×100%≈88.8%...................
(2分)
(注:三个方程式得1分;若未写方程式,写出正确关系式也给1分。其它合理计算也参照给分)
【解析】


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
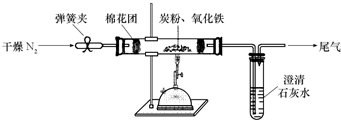
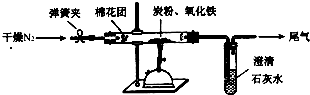 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学能 | B、生物质能 | C、太阳能 | D、地热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com