
| A. | 溶液中离子数目增加,导电性增强 | |
| B. | 加水促进醋酸电离,但[H+]、[OH-]均减小 | |
| C. | 加水稀释到1000 mL,溶液的pH=5 | |
| D. | $\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大 |
分析 醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用温度与电离常数的关系、酸碱混合时PH的计算来解答.
解答 解:A.因醋酸溶液中加水稀释,促进电离,则液中导电粒子的数目增多,但溶液的体积增大较快,所以离子浓度减小,溶液的导电性减弱,故A错误;
B.加水促进醋酸电离,但溶液的体积增大较快,所以[H+]减小,而[OH-]增大,二者的乘积不变,故B错误;
C.加水稀释到1000 mL,促进醋酸的电离,所以氢离子的物质的量增大,所以溶液的pH变化小于2个单位,即溶液的pH<5,故C错误;
D、加水促进醋酸电离,但溶液的体积增大较快,所以[H+]减小,由于K=$\frac{[C{H}_{3}CO{O}^{-}]×[{H}^{+}]}{[C{H}_{3}COOH]}$保持不变,所以$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大,故D正确;
故选D.
点评 本题考查弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
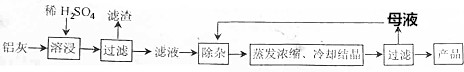
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 稀释后溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 | |
| B. | 室温时,0.1 mol•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O?HCO3-+OH-向正反应方向移动,则溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
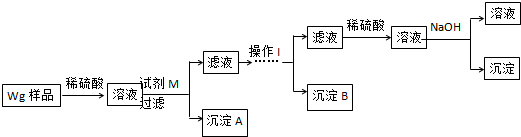
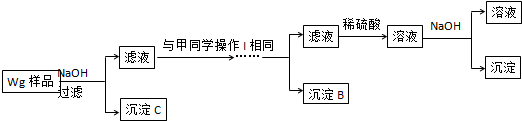
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
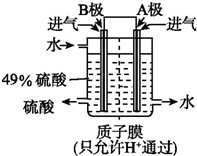 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com