
分析 ①次氯酸具有强氧化性,能够与有色物质发生氧化还原反应而导致有色物质褪色,且反应为非可逆的;
②O3、H2O2和Cl2与等体积等浓度的品红溶液分别反应,至完全褪色时,发现消耗三种漂白剂的物质的量相同,说明三种物质转移电子物质的量相等;
③反应速率快慢是由物质本身性质决定的,外界只是影响因素;
④物质的浓度越小,反应速率越小;
⑤产生的无色无味的气体是氧气,说明双氧水中氧元素被次氯酸根离子氧化成氧气,据此写出反应的离子方程式;
⑥若次氯酸根离子参与了反应,则反应后的溶液中一定含有氯离子,可用稀硝酸和硝酸银进行检验.
解答 解:①HClO检验强氧化性,能与很多有机色质发生氧化还原反应,且生成物较稳定,加热不会恢复,
故答案为:氧化还原;
②O3、H2O2和Cl2与等体积等浓度的品红溶液分别反应时,这三种物质具有强氧化性而使品红溶液褪色,至完全褪色时,发现消耗三种漂白剂的物质的量相同,说明三种物质转移电子物质的量相等,即每摩尔物质得电子数相等,
故答案为:得电子数;
③反应速率快慢是由物质本身性质决定的,外界只是影响因素,O3漂白速度比H2O2漂白速度快的主要原因是氧化性:O3>H2O2,
故答案为:氧化性O3>H2O2;
④物质的浓度越小,反应速率越小,氯气溶解性较小,1体积水只能溶解2体积氯气,所以氯气和水反应生成的HClO浓度较小,则Cl2漂白速度最慢,
故答案为:Cl2与H2O反应生成HClO浓度较小;
⑤生成的无色无味的气体应该为氧气,说明双氧水被次氯酸根离子氧化成氧气,反应的离子方程式为:H2O2+ClO-═Cl-+H2O+O2↑,
故答案为:H2O2+ClO-═Cl-+H2O+O2↑;
⑥可以检验反应后的溶液中是否含有氯离子进行判断次氯酸根离子是否发生反应,需要用到的试剂为AgNO3溶液和稀HNO3,
故答案为:AgNO3溶液和稀HNO3.
点评 本题考查性质实验方案的设计,题目难度的,设计漂白原理、化学反应速率影响因素、氧化性强弱判断、离子方程式书写、实验方案的设计与评价等知识,需要明确决定反应速率的是物质本身的性质,外界只是影响因素,弄清二氧化硫与这三种物质漂白原理的区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘晶体、碘蒸气是同素异形体 | |
| B. | 固态NaCl和HCl的熔化所克服的作用力不同 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 金刚石和石墨是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
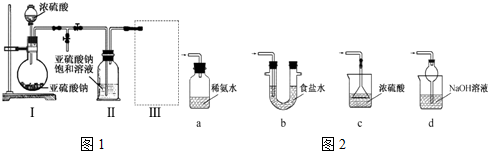

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的结构简式为:HOCH2CH=CHCH2OH | |
| B. | 反应③的转化条件a为:NaOH醇溶液,加热 | |
| C. | 1,3-丁二烯与等物质的量的Br2发生加成,所得产物可能有2种 | |
| D. | ①、②、③的反应类型依次为取代反应、加成反应、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Q | R | ||
| T | W |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com