
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
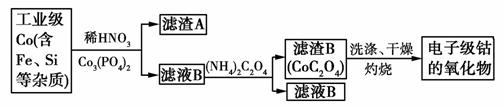
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、________和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)2和Fe(OH)3外还有________(填化学式),加入Co3(PO4)2的目的是__________________。
(3)Co与稀硝酸反应生成Co2+的离子方程式为:_____________。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:
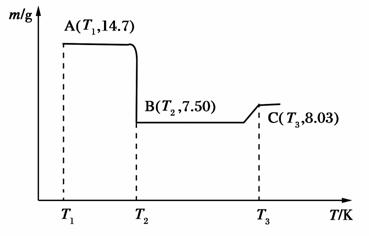
写出下列化学反应方程式:
①AB段:____________________________________________;
②BC段:____________________________________________。
解析:本题考查电子级钴的氧化物的制取流程,意在考查考生对化工流程的综合分析能力。(1)过滤时还需要的仪器为玻璃棒。(2)Si不溶于稀HNO3,因此滤渣A中还含有Si。根据制取流程可知,需要分离出Fe3+,因此加入Co3(PO4)2的目的是调节溶液pH,使Co2+不沉淀,而使Fe3+完全沉淀。(3)Co与稀HNO3发生氧化还原反应:3Co+8H++2NO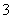 ===3Co2++4H2O+2NO↑。
===3Co2++4H2O+2NO↑。
(4)A点物质为CoC2O4,14.7 g CoC2O4的物质的量为0.1 mol,B、C点物质均为钴的氧化物,设其化学式为CoxOy,对于B点物质, ×(59x+16y)=7.50,得
×(59x+16y)=7.50,得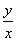 =1,故B点物质为CoO,对于C点物质,
=1,故B点物质为CoO,对于C点物质, ×(59x+16y)=8.03,得
×(59x+16y)=8.03,得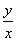 ≈
≈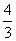 ,故C点物质为Co3O4,故AB段的反应为CoC2O4
,故C点物质为Co3O4,故AB段的反应为CoC2O4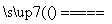 CoO+CO↑+CO2↑;BC段的反应为6CoO+O2
CoO+CO↑+CO2↑;BC段的反应为6CoO+O2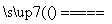 2Co3O4。
2Co3O4。
答案:(1)玻璃棒(1分)
(2)Si(1分) 调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀(3分)
(3)3Co+8H++2NO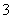 ===3Co2++4H2O+2NO↑(3分)
===3Co2++4H2O+2NO↑(3分)
(4)①CoC2O4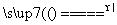 CoO+CO↑+CO2↑(3分)
CoO+CO↑+CO2↑(3分)
②6CoO+O2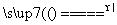 2Co3O4(3分)
2Co3O4(3分)


科目:高中化学 来源: 题型:
煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料,下列不属于以煤、石油和天然气为主要原料生产的合成材料是
A.塑料 B.合成橡胶 C.淀粉 D.合成纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应: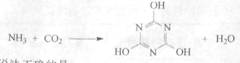
下列有关三聚氰胺的说法正确的是
A、分子式为C3H6N3O3 B、分子中既含极性键,又含非极性键
C、属于共价化合物 D、生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是以实验为基础的学科,下列有关实验的描述正确的是( )
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
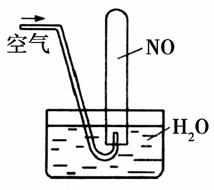
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA
C.常温常压下,20 g D2O含有的原子总数为3NA
D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是
A.K+、H+、SO42-、OH- B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32- D.Na+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中,正确的是
A.用湿润的红色石蕊试纸检验氨气
B.在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl—
C.将熟石灰和氯化铵混合加热,可以制备氨气
D.将烧瓶中的浓氨水加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com