
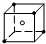
| 6+2 |
| 2 |
 ,
, ;
;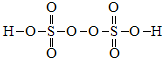 ,所以4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,所以硫元素显+6价,
,所以4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,所以硫元素显+6价,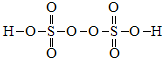 ;氧元素的化合价有-1、-2,硫元素的化合价为+6;
;氧元素的化合价有-1、-2,硫元素的化合价为+6;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、由于键能EH-F>EH-Cl,故氢化物的沸点:HF>HCl |
| B、由于分子中可电离的H+个数H2SO4>CH3COOH,故两者的酸性:H2SO4>CH3COOH |
| C、由于元素的非金属性N>P,故最高价氧化物的水化物的酸性:HNO3>H3PO4 |
| D、由于氧化性Fe3+>Cu2+,故还原性Fe2+>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知常温下pH=2的高碘酸(H3IO5)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性;0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈中性.请回答下列问题:
(1)已知常温下pH=2的高碘酸(H3IO5)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性;0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈中性.请回答下列问题:| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
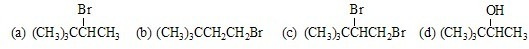
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡不移动 |
| B、平衡向正反应方向移动 |
| C、新平衡时各物质的浓度都比原平衡时增大 |
| D、C的质量分数减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com