
【题目】将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现血红色的是
A. FeOB. Fe2O3
C. FeCl3D. Fe2(SO4)3
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________________。
(2)烧杯间填满碎纸条的作用是________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)如果用50mL0.50mol/L硝酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列 有关R,W,X,Y,Z 5种元素的叙述中,正确的是( ) 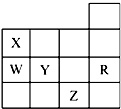
A.常压下5种元素的单质中Z单质的沸 点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物的还原性比Y的氢化物的还原性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强碱性溶液中可以大量共存的是( )
A. K+、Na+、HCO3-、Cl-B. Na+、Ba2+、AlO2-、NO3-
C. NH4+、K+、Cl-、NO3-D. K+、Na+、Cu2+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序是 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) . a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是 ( )
A.Na2CO3溶液
B.FeCl3溶液
C.饱和Ca(OH)2溶液
D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
A. 反应达到平衡时共放出46.2 kJ的热量
B. 若将容器体积压缩至0.5L,可提高单位体积内活化分子百分数,从而加快正反应速率,降低逆反应速率
C. 任何时刻均有:υ(N2)=3υ(H2)=2υ(NH3)
D. 若保持容器体积不变,继续通入0.5mol N2和1.5mol H2,则N2的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 合金的熔点一般比各成分金属的熔点高
B. 生铁的硬度比纯铁的硬度大
C. 胶体区别与其他分散系的本质特征是能发生丁达尔现象
D. 因为氯气溶于水可以导电,所以氯水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 氮氧化物可导致光化学烟雾
D. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com