
| 1 |
| 4 |
| 3 |
| 4 |
| 1 |
| 8 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
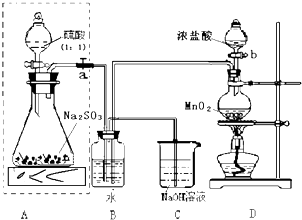
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33% | B、40% |
| C、50% | D、67% |
查看答案和解析>>
科目:高中化学 来源: 题型:
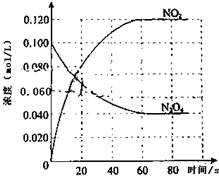 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑥ | B、②③⑦ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应属于置换反应 |
| B、C是还原剂,发生还原反应 |
| C、SiO2是氧化剂,在反应中还原 |
| D、氧化还原反应的实质是电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中每生成1 mol N2O,消耗1.5 mol CO |
| B、等物质的量的N2O和CO2含有相等的电子数 |
| C、N2O只具有氧化性,无还原性 |
| D、反应中每生成1 mol N2O,电子转移的物质的量为3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com