
| ||
| A、该反应属于置换反应 |
| B、C是还原剂,发生还原反应 |
| C、SiO2是氧化剂,在反应中还原 |
| D、氧化还原反应的实质是电子的转移 |
| ||


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、酸性:H2SiO3>H2CO3 |
| B、碱性:Mg(OH)2>Al(OH)3 |
| C、稳定性:SiH4>PH3 |
| D、原子半径:N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
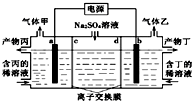 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A、a极与电源的负极相连 |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阳离子交换膜(允许阳离子通过) |
| D、a电极反应式为2H2O+2e-═2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4(g)+2O2(g)=CO2(g)+4H2O(g)△H=-890 kJ/mol | ||||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | ||||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
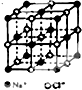 氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.
氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、③ | C、⑤ | D、⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O和Na2O2混合物中含阴离子的总数为NA |
| B、标准状况下,22.4 LCCl4含CCl4分子为NA |
| C、1mol H3O+含质子数为10 NA |
| D、1 L0.1 mol?L-1的CuCl2溶液中含Cu2+为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com