
【题目】下列有关物质结构和性质的说法不正确的是( )
A. 分子式为C5H9O2Cl且能与饱和NaHCO3溶液反应产生气体的有机物有12种(不含立体结构)
B. 已知引发某疫情的病毒对化学药品很敏感,乙醇、漂白粉溶液均可将病毒氧化而达到消毒的目的
C. 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g
D. 按系统命名法,化合物![]() 的名称为3-甲基-5,7-二乙基癸烷
的名称为3-甲基-5,7-二乙基癸烷
【答案】B
【解析】
A.分子式为C5H9O2Cl且能与饱和NaHCO3溶液反应产生气体说明该有机物为饱和一元羧酸的一氯代物,分子组成为C4H9—COOH的结构有四种,分别是①CH3CH2CH2CH2—COOH、②(CH3)2CHCH2—COOH、③(CH3)3C—COOH、④CH3CH2CH(CH3)—COOH,其中①分子中烃基上有四种不同化学环境的氢原子,则其一氯代物有四种;②分子中烃基上有3种不同化学环境的氢原子,则其一氯代物有3种;③分子中烃基上有1种不同化学环境的氢原子,则其一氯代物有1种;④分子中烃基上有四种不同化学环境的氢原子,则其一氯代物有四种;则其同分异构体的总数为:4+3+1+4=12,故A说法正确;
B.乙醇、漂白粉溶液可以消毒是因为它们能使蛋白质发生变性,并不是氧化,故B说法错误;
C.乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,含氧的质量分数为a,则C、H元素质量分数之和=1-a,故H元素质量分数=(1-a)×1÷(1+6)= (1-a)/7,生成水的质量为14g×![]() ×9=18(1-a)g,故C说法正确;
×9=18(1-a)g,故C说法正确;
D. A.主链含10个C,3号C上有甲基,5、7号C上有乙基,名称为3-甲基-5,7-二乙基癸烷,故D说法正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】常用的激光打印机、复印机使用的墨粉主要成分之一就是Fe3O4,氧化沉淀法是工业生产Fe3O4的主要方法,其工艺流程如下图所示。已知:①工业绿矾主要成分是FeSO4·7H2O,②Fe(OH)2+2Fe(OH) 3=Fe3O4+4H2O
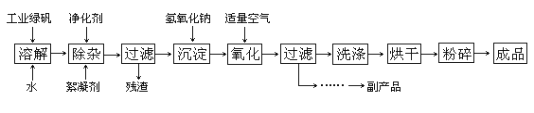
请回答下列问题:
(1)实验室中检验FeSO4溶液因氧化而变质的实验操作是__________
(2)写出沉淀和氧化过程的化学方程式____________、_____________
(3)氧化过程中,若通入过量空气会使成品含大量________杂质
(4)若原料中有278kg绿矾,则理论上可制得Fe3O4______kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关发泡塑料饭盒的叙述,不正确的是
A. 主要材质是高分子材料 B. 价廉、质轻、保温性能好
C. 适用于微波炉加热食品 D. 不适于盛放含油较多的食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生产生活等密切相关,下列说法不正确的是
A.PM2.5属于胶体,能产生丁达尔现象
B.中国芯的主要成分为单晶硅
C.人体缺乏铁元素,可以适当补充硫酸亚铁
D.节假日燃放烟花利用了焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为相关物质间的转化关系,其中甲、丙为生活中常见的金属单质,乙、丁为非金属单质且丁为气态,E为白色沉淀,D为浅绿色溶液。请回答:

(1)组成甲的元素在元素周期表中的位置为____________,请列举乙单质的一种用途__________,用电子式表示丁的形成过程________________________
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是________________(化学式)
(3)反应①的离子方程式为____________________________
(4)将B的稀溶液加水稀释,在图中画出溶液的pH随加水体积的变化趋势曲线。__________

(5)将等物质的量的A和NaOH混合溶于水,该溶液中离子的物质的量浓度由大到小的顺序为:________________________
(6)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为________________________________________,小辉同学欲设计实验,验证D溶液中的阳离子尚未完全被氧化,请你将实验过程补充完整:取反应液少许于试管中,滴加______________________,则证明D中的阳离子未完全被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中不正确的是
A.标准状况,11.2L氧气所含的原子数为NA
B.1.8g的NH4+离子中含有的电子数为NA
C.常温常压下,48gO3和O2的混合气体含有的氧原子数为3NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
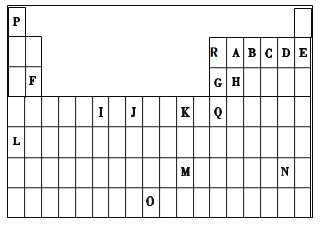
试回答下列问题:
(1)I的最高化合价为__________,J价电子排布图__________。
(2)写出基态时G元素原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为____________ 。
(3)第一电离能介于R、B之间的第二周期元素有_____________种。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)配合物甲的焰色反应呈紫色,其内界由中心离子J3+与配位体AB-构成,配位数为6,甲的水溶液可用于实验室J2+的定性检验,此方法检验J2+的离子方程式为_____________________。
(6)写出Q元素的简写电子排布式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的说法中,不正确的是
A.SO2能使品红溶液褪色,是因为SO2具有漂白性
B.SO2在空气中极易被氧化为SO3
C.SO2通入Na2SO3或NaHCO3溶液中均能发生反应
D.SO2是形成酸雨的大气污染物之一,主要来自于化石燃料的燃烧和工厂排放的废气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列叙述错误的是( )
A. 18gH2O中含有的质子数为10NA
B. 1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com