
【题目】下图为相关物质间的转化关系,其中甲、丙为生活中常见的金属单质,乙、丁为非金属单质且丁为气态,E为白色沉淀,D为浅绿色溶液。请回答:

(1)组成甲的元素在元素周期表中的位置为____________,请列举乙单质的一种用途__________,用电子式表示丁的形成过程________________________
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是________________(化学式)
(3)反应①的离子方程式为____________________________
(4)将B的稀溶液加水稀释,在图中画出溶液的pH随加水体积的变化趋势曲线。__________

(5)将等物质的量的A和NaOH混合溶于水,该溶液中离子的物质的量浓度由大到小的顺序为:________________________
(6)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为________________________________________,小辉同学欲设计实验,验证D溶液中的阳离子尚未完全被氧化,请你将实验过程补充完整:取反应液少许于试管中,滴加______________________,则证明D中的阳离子未完全被氧化。
【答案】第三周期第IIIA族 光电池或半导体材料 H· + ·H → H︰H H2SiO3 Al3+ + 3AlO2-+ 6H2O═4Al(OH)3↓ 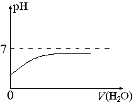 c(Na+)>c(OH-)>c(AlO2-)>c(H+) ClO-+ 2Fe2++ 2H+===Cl-+ 2Fe3++ H2O 滴加铁氰化钾{ K3[Fe(CN)6] }溶液,若生成蓝色沉淀
c(Na+)>c(OH-)>c(AlO2-)>c(H+) ClO-+ 2Fe2++ 2H+===Cl-+ 2Fe3++ H2O 滴加铁氰化钾{ K3[Fe(CN)6] }溶液,若生成蓝色沉淀
【解析】
应用元素化合物知识,结合题中文字信息,推断框图中各物质,进而回答相关问题。
生活中常见金属单质有铝、铁、铜,图中甲能与稀盐酸、NaOH溶液反应生成气体非金属单质丁,则甲为Al,丁为H2,A为NaAlO2溶液,B为AlCl3溶液,进而白色沉淀E为Al(OH)3。因D为浅绿色溶液,则丙为Fe,D为FeCl2溶液。非金属单质乙能与NaOH溶液反应生成H2,则乙为Si,C为Na2SiO3溶液。
(1)甲(Al)原子核外有3个电子层,最外层有3个电子,在元素周期表中位于第三周期第IIIA族。乙单质(Si)是常用的半导体材料,用于光电池、计算机芯片。电子式表示丁(H2)的形成过程为H· + ·H → H︰H。
(2)在Na2SiO3溶液中滴入稀盐酸得到硅酸胶体,胶粒成分是H2SiO3。
(3)反应①为双水解反应,其离子方程式为Al3+ + 3AlO2-+ 6H2O═4Al(OH)3↓。
(4)AlCl3溶液中存在水解平衡Al3+ + 3H2O![]() Al(OH)3+ 3H+,加水稀释时平衡右移,n(H+)增大,c(H+)减小,pH增大,但始终小于7。
Al(OH)3+ 3H+,加水稀释时平衡右移,n(H+)增大,c(H+)减小,pH增大,但始终小于7。
(5)等物质的量NaAlO2和NaOH的混合溶液中,溶质完全电离,c(Na+)最大;AlO2-水解AlO2-+ 2H2O![]() Al(OH)3+OH-,使c(OH-)>c(AlO2-);考虑水电离,c(H+)最小。故溶液中离子的物质的量浓度由大到小的顺序c(Na+)>c(OH-)>c(AlO2-)>c(H+)。
Al(OH)3+OH-,使c(OH-)>c(AlO2-);考虑水电离,c(H+)最小。故溶液中离子的物质的量浓度由大到小的顺序c(Na+)>c(OH-)>c(AlO2-)>c(H+)。
(6)反应②中盐酸过量,则D溶液中溶质为FeCl2和HCl,滴加84消毒液(NaClO)后发生氧化还原反应,该反应的离子方程式为ClO-+ 2Fe2++ 2H+==Cl-+ 2Fe3++ H2O。证明Fe2+未完全被氧化,即检验Fe2+,可滴加铁氰化钾{ K3[Fe(CN)6] }溶液,生成蓝色沉淀。


科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:在加热条件下将24g CuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g。下列有关叙述中不正确的是( )
A. 原混合物中CuO与Fe2O3物质的量比为1:1
B. 反应后所得CO2的物质的量为0.4mol
C. 实验过程中需要的CO 质量为11.2g
D. 原混合物中CuO与Fe2O3的质量比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为 ( )
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子,并尽可能减少AlCl3的损失.请回答下列问题:
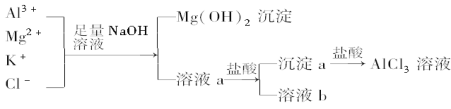
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________、________、________.氢氧化钠溶液能否用氨水代替,为什么?______________________.
(2)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制溶液的pH,为什么?________;为此,改进方法是____________________.
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶液后,如何得到AlCl3晶体?____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出A、B元素的元素符号:A________,B________。
(2)写出C元素基态原子核外电子排布式:C______________________________。
(3)写出D元素基态原子核外电子轨道表示式:D_____________________________。
(4)写出B、C两种元素单质在一定条件下反应的化学方程式:___________________。
(5)写出B元素单质和氢化物的电子式:单质________,氢化物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和性质的说法不正确的是( )
A. 分子式为C5H9O2Cl且能与饱和NaHCO3溶液反应产生气体的有机物有12种(不含立体结构)
B. 已知引发某疫情的病毒对化学药品很敏感,乙醇、漂白粉溶液均可将病毒氧化而达到消毒的目的
C. 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g
D. 按系统命名法,化合物![]() 的名称为3-甲基-5,7-二乙基癸烷
的名称为3-甲基-5,7-二乙基癸烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次减小,其中只有Z为金属元素,X、Y、Z同周期且位于不同奇数族,Z、W同主族,Y、Z的原子序数相差4。下列说法正确的是( )
A. W的简单阴离子半径一定大于Z的简单阳离子半径
B. 非金属性:X>Y,所以X和Y分别对应含氧酸的酸性:X一定强于Y
C. X、 Y形成的单质一定都是双原子分子
D. Z、W形成化合物的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是
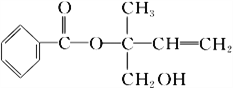
A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组的同学拟用下图所示的装置从含碘废液(除H2O外,还有I2、I-等)中回收碘。回答下列问题:

(1)装置A中发生反应的离子方程式为________。
(2)仪器X的名称为________;装置D的作用是________。
(3)装置C中球形冷凝管冷却水从________(填“a”或“b”)进入,反应控制在较低温度下且保持溶液pH =2进行,其主要原因是________。
(4)三口烧瓶中液体经过滤得粗碘,粗碘可经________(填操作名称)得到纯碘。
(5)为测定某含碘废水中I2的含量,取样l00mL,调节溶液pH后,滴加2滴淀粉溶液,然后用0.02500mol/LNa2S2O3标准溶液滴定,消耗标准液18.15mL。则滴定终点时的现象为________,含碘废水中I2的含量=________mg/mL(结果保留小数点后三位,已知:I2 +2S2O32-=2I-+S4O62-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com