
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B.常温常压下,22 g14CO2中所含分子数为0.5 NA |
| C.室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D.7.8g Na2O2与足量水反应,转移电子数为0.2NA |
A
解析试题分析:由于关系式SO3~3O中氧原子与三氧化硫的的物质的量之比等于系数之比,则0.5mol三氧化硫中含有1.5mol氧原子,故A正确;14CO2的相对分子质量为46,根据m/M=n可求得其物质的量小于0.5mol,故B错;溶液中氢离子浓度=10—pHmol/L=0.1mol/L,溶液的体积为1L,则由cV=n可求得硫酸溶液中氢离子的物质的量为0.1mol,故C错;过氧化钠的式量为78,先由m/M=n可求得其物质的量为0.1mol,由于转移电子数等于化合价升降总数,则2Na2O2+2H2O=4NaOH+O2↑~2e—中转移电子与过氧化钠的物质的量之比等于系数之比,则该反应中实际转移0.1mol电子,故D错。
考点:考查阿伏加德罗常数,涉及物质的量、质量、质量数、相对分子质量、摩尔质量、体积、pH、物质的量浓度之间的计算,以及物质的组成、氧化还原反应中转移电子数、物质的量在化学方程式(或关系式)中的应用、强电解质等。


科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
| A.1L0.1mol·L-1的氨水中含有的NH3分子数为0.1NA |
| B.标准状况下,2. 24L的CCl4中含有的C-Cl键数为0.4NA |
| C.常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
| D.标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.7.45gNaClO中含有6.02×1022个NaClO分子 |
| B.1.00 molNaClO中所有ClO-的电子总数为26×6.02×1023 |
| C.1 L2 mol/L明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 |
| D.将2.00 mol明矾完全溶于1.00 L 水中,得到溶液的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.22.4L NH3中含氮原子数为NA |
| B.1 mol Na2O2与水完全反应时转移的电子数为NA |
| C.1 L 0.1mol·L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.通常情况下,7.6g CS2含有非极性键数目为0.4NA |
| B.22.4L CO气体与1mol N2所含的电子数相等 |
| C.将7.8gNa2O2放入足量的水中,反应时转移0.1NA电子 |
| D.25℃时,1L pH=13的Ba(OH)2溶液中含OH—数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.常温常压下,18gH218O含有的原子总数为3NA |
| B.标准状况下,4.2gCH2=CH2和CH3CH=CH2的混合气体中所含有的碳原子数为0.3NA |
| C.将0.1molCl2通入1L水中,转移的电子数目为0.1NA |
| D.0.1mol·L-1Al2(SO4)3溶液中含有的Al3+总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.足量Fe与1 mol Cl2燃烧反应时,转移的电子数为3 NA |
| B.1 mol NO2与足量H2O反应,转移的电子数为NA |
| C.常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为0.2 NA |
| D.高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答: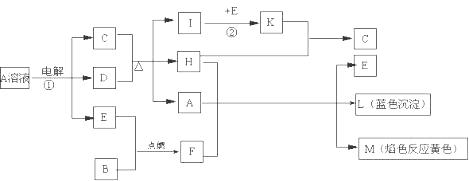
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com