
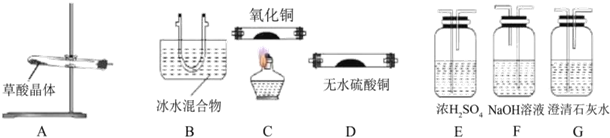
分析 (1)猜想其受热分解产物为CO2、CO和H2O,草酸晶体(H2C2O4•2H2O)在100℃时开始升华,157℃时大量升华并开始分解,草酸蒸气在低温下可冷凝为固体,所以生成的气体中含有草酸蒸气,应该检验生成产物成分时除去草酸,因为检验二氧化碳需要氢氧化钙溶液,溶液中含有水分,所以要先用无水硫酸铜检验水蒸气;用CuO检验CO,CO生成二氧化碳,为防止CO生成的CO2干扰产物中CO2的检验,所以要先检验CO2、后检验CO;
(2)配制480mL0.1mol•L-1的草酸溶液需要500mL容量瓶,则需要草酸晶体质量=cVM=0.1mol/L×0.5L×126g/mol;
(3)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性;
B.测定0.1molL-1草酸溶液的pH,根据氢离子浓度和草酸浓度相对大小判断电解质强弱;
C.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸;
D.测定草酸钠溶液的pH,根据溶液酸碱性判断草酸酸性强弱;
(4)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,据此判断离子浓度大小;
(5)酸性条件下,KMnO4具有强氧化性,酸性KMnO4溶液和草酸发生氧化还原反应而使酸性高锰酸钾溶液褪色,Mn元素化合价由+7价变为+2价,则C元素生成稳定氧化物CO2,根据转移电子相等、原子守恒、电荷守恒书写方程式;
(6)①计算出配制的100mL样品溶液会消耗高锰酸钾溶液的体积,再根据n=cV计算出消耗高锰酸钾的物质的量,然后根据反应2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O计算出样品中含有草酸钙的物质的量,最后计算出样品中草酸钙的质量分数;
②测定结果偏高,说明消耗的酸性高锰酸钾溶液体积偏大,如果不考虑操作引起的误差,则说明溶液中可能含有其它还原性的物质.
解答 解:(1)①猜想其受热分解产物为CO2、CO和H2O,草酸晶体(H2C2O4•2H2O)在100℃时开始升华,157℃时大量升华并开始分解,草酸蒸气在低温下可冷凝为固体,所以生成的气体中含有草酸蒸气,应该检验生成产物成分时除去草酸,因为检验二氧化碳需要氢氧化钙溶液,溶液中含有水分,所以要先用无水硫酸铜检验水蒸气;用CuO检验CO,CO生成二氧化碳,为防止CO生成的CO2干扰产物中CO2的检验,所以要先检验CO2、后检验CO,用B冷却得到草酸晶体、用C氧化CO、用D检验水、用E干燥CO、用F吸收二氧化碳、用G检验二氧化碳,所以其排列顺序是A→B→D→G→F→E→C→G,故答案为:D;G;
②冰水混合物的作用是除去产物中草酸蒸气,防止干扰实验,
故答案为:除去草酸蒸气,防止干扰实验;
③CO具有还原性,能还原CuO生成Cu,生成的二氧化碳能使澄清石灰水变浑浊,则能证明含有CO的现象是:黑色固体变成红色,且澄清的石灰水变浑浊,
故答案为:黑色固体变成红色,且澄清的石灰水变浑浊;
④CO有毒,不能直接排空,所以要有尾气处理装置,
故答案为:没有CO尾气处理装置;
(2)配制480mL0.1mol•L-1的草酸溶液需要500mL容量瓶,则需要草酸晶体质量=cVM=0.1mol/L×0.5L×126g/mol=6.3g,
故答案为:6.3;
(3)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性,但不能说明草酸部分电离,所以不能证明草酸是弱酸,故A错误;
B.测定0.1molL-1草酸溶液的pH,如果溶液中氢离子浓度小于草酸浓度的2倍,就说明草酸部分电离为弱电解质,故B正确;
C.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸,但不能说明草酸部分电离,则不能证明草酸是弱酸,故C错误;
D.测定草酸钠溶液的pH,如果草酸钠是强酸强碱盐,溶液呈中性,如果草酸钠是弱酸强碱盐,溶液呈碱性,所以能证明草酸是否是弱电解质,故D正确;
故答案为:BD;
(4)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,所以溶液中c(H+)>c(C2O42-),溶液呈酸性则c(OH-)浓度最小,则溶液中离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)酸性条件下,KMnO4具有强氧化性,酸性KMnO4溶液和草酸发生氧化还原反应而使酸性高锰酸钾溶液褪色,Mn元素化合价由+7价变为+2价,则C元素生成稳定氧化物CO2,根据转移电子相等、原子守恒、电荷守恒书写方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(6)②配制的100mL样品溶液会消耗高锰酸钾溶液的体积为VmL×$\frac{100mL}{25mL}$=4VmL,消耗高锰酸钾的物质的量为:0.0100mol•L-1×4V×10-3L=4V×10-5mol,根据反应2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,mg样品中含有草酸钙的物质的量为:4V×10-5mol×$\frac{5}{2}$=V×10-4mol,菜中草酸钙的质量分数为:$\frac{88g/mol×V×1{0}^{-4}mol}{mg}$×100%=$\frac{0.88V}{m}$%,
故答案为:$\frac{0.88V}{m}$%;
③用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,如果不考虑操作引起的误差,则溶液中可能含有其他还原性物质会消耗高锰酸钾,导致测定结果偏高,
故答案为:溶液中可能含有其他还原性物质会消耗高锰酸钾.
点评 本题考查性质实验方案设计,为高频考点,题目难度中等,涉及氧化还原反应、离子浓度大小比较、弱电解质的判断、溶液配制、实验操作先后顺序判断等知识点,明确物质的性质及实验原理是解本题关键,难点是(1)中物质检验先后顺序,易错点是(2)的计算,注意应该配制500mL溶液而不是480mL溶液.


科目:高中化学 来源: 题型:解答题
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物一定不含共价键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 气态单质的分子中一定存在共价键 | |
| D. | 非金属元素的化合物一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷对人无毒,除去与否无关紧要 | |
| B. | 含磷的污水是很好的肥料,不必除去 | |
| C. | 含磷污水排到自然水中,引起藻类繁殖,使水变质,必须除去 | |
| D. | 磷是生物的营养元素,不必除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能发生氧化反应而乙酸不能发生氧化反应 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 乙醇和乙酸能发生酯化反应,酯化反应和酯的水解反应互为逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 试剂 | FeCl3溶液 | 酸性KMnO4溶液 | NaHCO3溶液 |
| 现象 | 溶液变紫色 | 褪色 | 放出气体 |
| A. | 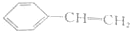 | B. | 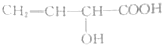 | ||
| C. | 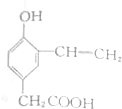 | D. | 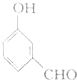 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水与乙酸的混合物 | |
| B. | 某溶液加氯化钡溶液有白色沉淀生成,说明原溶液中一定有SO42- | |
| C. | 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 | |
| D. | 从碘水提取碘可用乙醇作萃取剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com