
【题目】钒(V)为过渡元素,可形成多价态化合物,在工业催化、新材料、新能源等领域有广泛应用。
(1)金属钒熔点很高,可由铝热反应制得。
已知25℃、101 KPa时
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJmol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJmol-1
则用铝热反应冶炼金属V(s)的热化学方程式为______。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图所示:
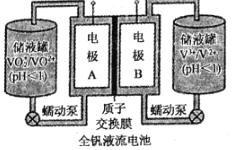
查阅相关资料可知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
①该电池放电时,VO2+发生还原反应,则正极的反应式是______。
②当完成储能时,负极溶液的颜色为______。
③电池放电时,负极区溶液的pH将______(填“增大”、“减小”或“不变”)。
④用该钒电池在铁制品上镀铜,铁制品应与电池的______极(填“A“或“B“)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128g,此时转移电子的物质的量为______。
【答案】10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s) △H=(2.5a-1.5b)kJ·mol-1或(![]() -
-![]() )kJ·mol-1 VO2++e-+2H+=VO2++H2O 紫色 增大 B 2mol
)kJ·mol-1 VO2++e-+2H+=VO2++H2O 紫色 增大 B 2mol
【解析】
(1)铝热反应冶炼钒的化学方程式为10Al+3V2O5=5Al2O3+6V,根据盖斯定律进行计算;
(2)①VO2+发生还原反应,V得到电子,化合价降低,生成VO2+,然后根据电解质环境写出电极反应式;
②储能是充电过程,电池负极与电源的负极相连,即该电极为阴极,应是V3+和V2+之间的转化,根据表中现象进行分析;
③根据原电池工作原理,阳离子从负极移向正极,进行分析;
④电镀,待镀金属作阴极,镀层金属作阳极,根据两极电极反应式进行计算;
(1) 铝热反应冶炼钒的化学方程式为10Al+3V2O5=5Al2O3+6V,4Al(s)+3O2(g)=2Al2O3(s) ①,4V(s)+5O2(g)=2V2O5(s) ②,根据盖斯定律,![]() ①-
①-![]() ②,因此有10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s) △H=(2.5a-1.5b)kJ·mol-1或(
②,因此有10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s) △H=(2.5a-1.5b)kJ·mol-1或(![]() -
-![]() )kJ·mol-1;
)kJ·mol-1;
(2)①放电时,VO2+发生还原反应,说明VO2+得到电子,正极上得电子,化合价降低,发生还原反应,即电极A为正极,电极B为负极,根据装置图,正极电极反应式为VO2++e-+2H+=VO2++H2O;
②储能为充电过程,电池的负极与电源的负极相连,该电池B为阴极,电极反应式为V3++e-=V2+,该电极溶液颜色为紫色;
③电池放电时,阳离子从负极向正极移动,即H+从右移向左,负极区溶液c(H+)减小,pH增大;
④铁制品上镀铜,铁制品作阴极,铜作阳极,因此铁制品应与电池的B极相连;阴极反应式为Cu2++2e-=Cu,阳极反应式为Cu-2e-=Cu2+,令转移电子物质的量为amol,阴极质量增加![]() ,阳极质量减少
,阳极质量减少![]() ,因此两极质量差为
,因此两极质量差为![]() +
+![]() =128g,解得a=2mol。
=128g,解得a=2mol。


 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W:__、X:__、Y:__、Z__。
(2)以上4个化学反应,属于氧化还原反应的是__(填反应序号),反应中还原剂是__(写化学式)。反应②中每生成标况下3.36L气体,转移电子的数目为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项有机物同分异构体的数目,与分子式为C5H12O且含有两个甲基的醇的有机物数目相同的是(不含立体异构):
A.分子式为CH2BrCl 的卤代烃
B.分子式为C4H8O2的酯
C.![]() 的一溴代物
的一溴代物
D.立方烷(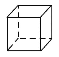 )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③运用价层电子对互斥理论,CO32-离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
A.1个
B.2个
C.3个
D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,纳米0价金属能去除地下水中的NO3-,不同初始pH和不同金属组成对NO3-的去除效果如图所示。图1初始pH=5.5,图2初始pH=2,NO3-初始浓度均为50mgL-1,纳米级金属添加量均为2gL-1.下列说法正确的是
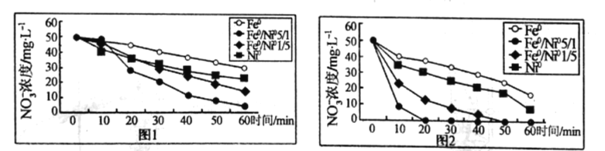
A.纳米铁的去除效果优于纳米镍
B.当加入的金属是Fe0/Ni05/1,在不同的初始pH下,经过60min后,pH=2时NO3-的去除率比pH=5.5时的大
C.图2纳米铁反应60min时NO3-去除率为67.2%,则60min内v(NO3-)=0.56molL-1min-1
D.其他条件相同时,若pH过低,可能会导致去除率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
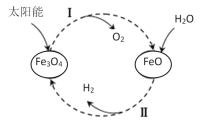
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q__0(填“>”或“<”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=__。

(3)400℃时,压强恒定的密闭容器中进行上述反应。该可逆反应达到平衡的标志是__(填字母)。
A.v逆(H2)=v正(CO)
B.容器的总体积不再随时间而变化
C.混合气体的密度不再随时间变化
D.CO、H2O、CO2、H2的分子数之比为1∶1∶1∶1
(4)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020molL-1,该条件下,CO的最大转化率为__。
(5)若在850℃时进行,某时刻时测得CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1mol、0.5mol、0.6mol、0.6mol,此时V正__V逆。(填“>”或“<”或“=”)
(6)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:

已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研制的人造纳米“竹子”可充分利用太阳能,并将其有效转化为氢能源。“竹子”的竹节和竹茎,分别由硫化镉和硫化锌两种不同的半导体材料组成。
(1)已知Cd与Zn位于同一副族,且在Zn的下一周期,则Cd的价电子排布图为___。已知Zn与Cu的能量变化如图所示,试解释步骤②吸收能量大于步骤④的原因___。
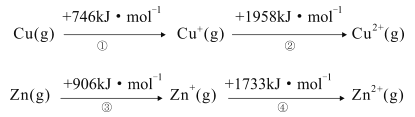
(2)CdS燃烧可生成CdO和SO2,SO2在空气中遇到微尘会缓慢转化为SO3。SO2中S的杂化方式为___,SO3分子的空间构型为___。
(3)O、S、Se为同主族元素,已知其对应氢化物的相关数据如下表:
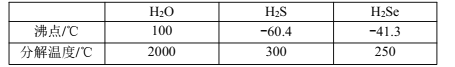
①H2Se沸点高于H2S的原因为___。
②H2O的分解温度高于H2S的原因为___。
(4)已知ZnS熔点为2830℃;CdS熔点为1750℃,则二者属于___晶体,ZnS熔点更高的原因为___。
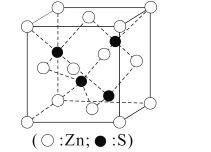
(5)如图为ZnS的晶胞图。若已知最近的锌离子之间距离为apm,则ZnS晶体的密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com