
【题目】下列各选项有机物同分异构体的数目,与分子式为C5H12O且含有两个甲基的醇的有机物数目相同的是(不含立体异构):
A.分子式为CH2BrCl 的卤代烃
B.分子式为C4H8O2的酯
C.![]() 的一溴代物
的一溴代物
D.立方烷(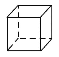 )的二氯代物
)的二氯代物
【答案】B
【解析】
分子式为C5H12O且含有两个甲基的醇的有机物的同分异构体有4种,分别为:CH3CH(OH)CH2CH2CH3、(C2H5)2CHOH、CH3CH2CH(CH3)CH2OH、(CH3)2CHCH2CH2OH。
A.分子式为CH2BrCl 的卤代烃只有一种,不符合题意;
B.分子式为C4H8O2的酯有甲酸丙酯、甲酸异丙酯、乙酸乙酯和丙酸甲酯四种,符合题意;
C.![]() 的一溴代物有5种,溴原子可以在甲基上、和甲基直接相连的碳原子上,还有在环上和甲基处于邻、间、对三个位置,共有5种,不符合题意;
的一溴代物有5种,溴原子可以在甲基上、和甲基直接相连的碳原子上,还有在环上和甲基处于邻、间、对三个位置,共有5种,不符合题意;
D.立方烷(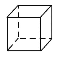 )的二氯代物有三种,分别为两个氯原子在立方烷构成的立方体的邻边、面对角线和体对角线,不符合题意;
)的二氯代物有三种,分别为两个氯原子在立方烷构成的立方体的邻边、面对角线和体对角线,不符合题意;
故选B。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
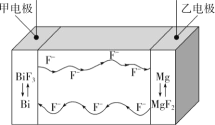
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为_____(填“强”或“弱”)酸,向H2A溶液中加水会使 的值_______ (填“增大”、“减小”或“不变”)。
的值_______ (填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则
①M的溶质可以是Na2A或_________,Na2A的水溶液pH__________ (填“<”、“ >”或“=”)7
②向Na2A溶液中加人__________ (填字母)可抑制其水解。
A. 氯化铵固体 B. KOH 固体 C. 水 D. 升高温度
③已知Ksp(CuA)=1.3![]() 10-36,向20mL1 mo1·L-1Na2A溶液中加入10mL1 mo1·L-1CuCl2溶液,混合后溶液的Cu2+为____________mo1·L-1。(忽略A2-的水解)
10-36,向20mL1 mo1·L-1Na2A溶液中加入10mL1 mo1·L-1CuCl2溶液,混合后溶液的Cu2+为____________mo1·L-1。(忽略A2-的水解)
(3)若溶液M由10mL1.00 mo1·L-1H2A溶液与10mL1.00mo1·L-1NaOH溶液混合而成,下列关于溶液M的说法正确的是______(填字母)。
A.c(A2-)+ c(HA-)+ c(H2A)=1 mo1·L-1
B.若溶液显酸性,则c(Na+)>c(HA-)> c(H+)>c(A2-)>c(OH-)
C.离子浓度关系:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D. 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1 mo1·L-1的Na2A、NaHA混合溶液中,![]() =______
=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种环境激素,存在如图转化关系:
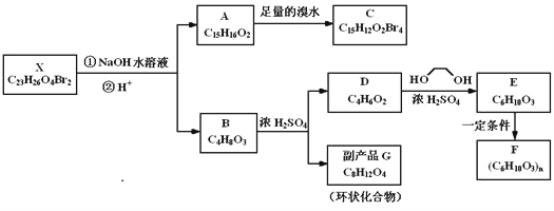
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H﹣NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。根据以上信息回答下列问题:
(1)下列叙述正确的是__;
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1mol X最多消耗6mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是__,A→C的反应类型是__;
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)__;
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__;
(5)写出E→F反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
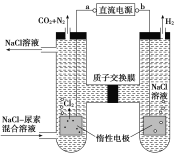
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示。下列说法不正确的是

A. Z、Y、X的原子半径依次减小,非金属性依次降低
B. Z、Y、W的最高价氧化物的水化物的酸性依次降低
C. WH4与Z元素的单质在一定条件下可发生化学反应
D. W的位置是第2周期,第IV A族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,在工业催化、新材料、新能源等领域有广泛应用。
(1)金属钒熔点很高,可由铝热反应制得。
已知25℃、101 KPa时
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJmol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJmol-1
则用铝热反应冶炼金属V(s)的热化学方程式为______。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图所示:
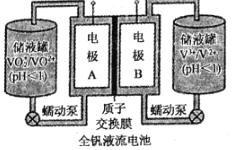
查阅相关资料可知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
①该电池放电时,VO2+发生还原反应,则正极的反应式是______。
②当完成储能时,负极溶液的颜色为______。
③电池放电时,负极区溶液的pH将______(填“增大”、“减小”或“不变”)。
④用该钒电池在铁制品上镀铜,铁制品应与电池的______极(填“A“或“B“)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128g,此时转移电子的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
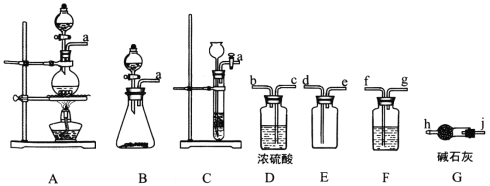
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的离子方程式为___________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
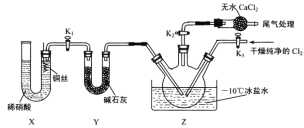
①实验室也可用 B 装置制备 NO , X装置的优点为___________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。
①设计实验证明 HNO2是弱酸:_____________。(仅提供的试剂:1 molL-1盐酸、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是__________,亚硝酰氯(ClNO)的质量分数为_________。(已知: Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com