
����Ŀ�������£�ijˮ��ҺM�д��ڵ�������Na+��A2-��HA-��H+��OH-��H2O��H2A����������ش��������⣺
(1)H2AΪ_____(����ǿ����������)�ᣬ��H2A��Һ�м�ˮ��ʹ ��ֵ_______ (����������������С������������)��
��ֵ_______ (����������������С������������)��
(2)��M����һ��������ɵ���Һ����
��M�����ʿ�����Na2A��_________��Na2A��ˮ��ҺpH__________ (����<������ >������=��)7
����Na2A��Һ�м���__________ (����ĸ)��������ˮ�⡣
A. �Ȼ�粒��� B. KOH ���� C. ˮ D. �����¶�
����֪Ksp(CuA)=1.3![]() 10-36����20mL1 mo1��L-1Na2A��Һ�м���10mL1 mo1��L-1CuCl2��Һ����Ϻ���Һ��Cu2+Ϊ____________mo1��L-1��(����A2-��ˮ��)
10-36����20mL1 mo1��L-1Na2A��Һ�м���10mL1 mo1��L-1CuCl2��Һ����Ϻ���Һ��Cu2+Ϊ____________mo1��L-1��(����A2-��ˮ��)
(3)����ҺM��10mL1.00 mo1��L-1H2A��Һ��10mL1.00mo1��L-1NaOH��Һ��϶��ɣ����й�����ҺM��˵����ȷ����______(����ĸ)��
A.c(A2-)+ c(HA-)+ c(H2A)=1 mo1��L-1
B.����Һ�����ԣ���c(Na+)>c(HA-)> c(H+)>c(A2-)>c(OH-)
C.����Ũ�ȹ�ϵ��c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D. 25��ʱ����ˮϡ�ͺ�n(H+)��n(OH-)�ij˻����
(4)Ũ�Ⱦ�Ϊ0.1 mo1��L-1��Na2A��NaHA�����Һ�У�![]() =______
=______
���𰸡��� ���� NaHA > B 3.9��10-36 BD 1.5
��������
(1)��Һ�д���H2A��HA����˵��H2AΪ���ᣬ��H2A��Һ�м�ˮ������ ������
������
(2)�����ں���Na+��A2����HA����H+��OH����H2O��H2A����˿ɵó�M�����ʣ�Na2A��ˮ��ҺA2��ˮ���Լ��ԣ�
����Na2A��Һˮ���Լ��ԣ�A. �Ȼ�粒�������ˮ�����ԣ�������ٽ���B. ����KOH���壬����ˮ�⣻C. ��ˮϡ�ͣ�ˮ�������ƶ����ٽ�ˮ�⣻D. �����¶ȣ�ˮ��ƽ�������ƶ����ٽ�ˮ�⣻
����20mL1 mo1��L-1Na2A��Һ�м���10mL 1 mo1��L-1CuCl2��Һ�����߷�Ӧ����CuA�������ȼ����Ϻ�c(A2��)���ٸ����ܶȻ�����ͭ����Ũ�ȡ�
(3)�ȵó���Ϻ�����Ϊ0.05 mo1��L-1NaHA��A. ���������غ������B. ����Һ�����ԣ�˵���������ˮ�⣬HA������ռ��Ҫ��C. ���ݵ���غ㣻D. 25��ʱ����ˮϡ�ͺ����ӻ��������䣬����Һ�������
(4)Ũ�Ⱦ�Ϊ0.1 mo1��L-1��Na2A��NaHA�����Һ�У����������غ�õ���
(1)��Һ�д���H2A��HA����˵��H2AΪ���ᣬ��H2A��Һ�м�ˮ������ƽ�������ƶ������������ʵ�������H2A���ʵ�����С����� ��ֵ���ʴ�Ϊ����������
��ֵ���ʴ�Ϊ����������
(2)����M����һ��������ɵ���Һ�����ں���Na+��A2����HA����H+��OH����H2O��H2A�����M�����ʿ�����Na2A��NaHA��Na2A��ˮ��ҺA2��ˮ���Լ��ԣ����pH > 7���ʴ�Ϊ��NaHA��>��
����Na2A��Һˮ���Լ��ԣ�
A. �Ȼ�粒�������ˮ�����ԣ�������ٽ�����A���������⣻
B. ����KOH���壬����ˮ�⣬��B�������⣻
C. ��ˮϡ�ͣ�ˮ�������ƶ����ٽ�ˮ�⣬��C���������⣻
D. �����¶ȣ�ˮ��ƽ�������ƶ����ٽ�ˮ�⣬��D���������⣻
������������ΪB��
����20mL1 mo1��L-1Na2A��Һ�м���10mL 1 mo1��L-1CuCl2��Һ�����߷�Ӧ����CuA��������˻�Ϻ�c(A2��)= ![]() �������Һ��Cu2+Ϊ
�������Һ��Cu2+Ϊ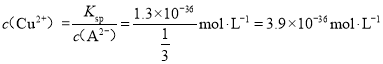 ���ʴ�Ϊ��3.9��10-36��
���ʴ�Ϊ��3.9��10-36��
(3)����ҺM��10mL1.00 mo1��L-1H2A��Һ��10mL1.00mo1��L-1NaOH��Һ��ϣ�����Ϊ0.05 mo1��L-1NaHA��
A. ���������غ�õ�c(A2��)+ c(HA��)+ c(H2A)=0.5 mo1��L-1����A����
B. ����Һ�����ԣ�˵���������ˮ�⣬HA������ռ��Ҫ����c(Na+)>c(HA��)> c(H+)> c(A��) > c(OH��)����B��ȷ��
C. ���ݵ���غ�õ���c(Na+)+c(H+)=c(HA��)+2c(A2��)+c(OH��)����C����
D. 25��ʱ����ˮϡ�ͺ����ӻ��������䣬����Һ����������n(H+)��n(OH��)�ij˻��������ӻ�����������Һ�����ƽ�������n(H+)��n(OH��)�ij˻����D��ȷ��
������������ΪBD��
(4)Ũ�Ⱦ�Ϊ0.1 mo1��L-1��Na2A��NaHA�����Һ�У����������غ�![]() ���ʴ�Ϊ��1.5��
���ʴ�Ϊ��1.5��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯���������ֲָĵ���������Ч�������Ʊ������칤ҵ����;�㷺����ҵ���Ը���¯��(��Ҫ�ɷ�ΪV2O5��������Fe2O3��FeO������)Ϊԭ����ȡ�����������Ĺ���������ͼ��ʾ��

(1)�����������з��Ļ��ϼ�Ϊ__��
(2)����¯�з�������Ҫ��Ӧ��ѧ����ʽΪ__��Ҳ�����Ȼ��ƺ��������洿����б��շ�Ӧ��д����Ӧ�Ļ�ѧ��Ӧ����ʽ__���÷�����ȱ���ǣ�__��
(3)��֪NH4VO3������ˮ����ˮ�е�Ksp������ͼ1��ʾ������ʵ���н��в���A����Ҫ�IJ���������__����10mL��NaVO30.2mol/L����Һ�м���������NH4Cl��Һ�����Ի�Ϲ����е�����仯������ʹVO3-������ȫ����NH4Cl��Һ����СŨ��Ϊ__��(����Һ��ij����Ũ��С��1��10-5mol/Lʱ����Ϊ�����ӳ�����ȫ)

(4)Ϊ�о����չ����з����Ļ�ѧ�仯��ij�о�С��ȡ234gNH4VO3����̽�������չ����м��ٵ��������¶ȱ仯��������ͼ2��ʾ����C���������ʻ�ѧʽΪ__��д��CD�η�����Ӧ�Ļ�ѧ����ʽ��__��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.12gNaHSO4������SO42-��ĿΪ0.1NA
B.2.0gD2O�к��е�������ΪNA
C.2.24LCl2������Na2SO3��Һ��Ӧʱת�Ƶĵ�����Ϊ0.2NA
D.��״���£�4.48 LHF����ԭ����ĿΪ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4���ƵĻ�����W��X��Y��Z������֮��������¹�ϵ��
��W![]() X��H2O��CO2��
X��H2O��CO2��
��Z��CO2��X��O2
��Z��H2O��Y��O2��
��X��Ca(OH)2��Y��CaCO3��
�Իش��������⣺
��1��W��X��Y��Z�Ļ�ѧʽ�ֱ���W��__��X��__��Y��__��Z__��
��2������4����ѧ��Ӧ������������ԭ��Ӧ����__(�Ӧ���)����Ӧ�л�ԭ����__(д��ѧʽ)����Ӧ����ÿ���ɱ����3.36L���壬ת�Ƶ��ӵ���ĿΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��M(OH)2��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����

A.25��ʱ��M(OH)2���ܶȻ�����KspΪ1x10-8
B.��M(OH)2��Һ�м���NaOH���岻��ʹ��Һ��Z���ΪX��
C.25��ʱ��M(OH)2��ˮ�е��ܶȻ����ܽ�ȱ�����KOH��Һ�еĴ�
D.�����¶ȣ���ʹ��Һ��Y���ΪX��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.��ѿ�Ǽ���ˮ�������ܷ���������Ӧ
B.����ˮ���ɼ��𱽷���Һ��2��4������ϩ�ͼױ�
C.�����������£�CH3CO18OC2H5��ˮ�������CH3CO18OH��C2H5OH
D.�øʰ���(![]() )�ͱ�����(
)�ͱ�����(![]() )���������γ�4�ֶ���
)���������γ�4�ֶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵĹ�ҵ��ˮ�Ĵ���������ͼ��ʾ��

��1��������ͼ�豸���н��е��Dz���________(��д��������)��ʵ��������һ������������_______(����������)���С�
�����豸�������豸��������A��______________(�ѧʽ����ͬ)�����豸�������豸��������B��___________��
�����豸���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
�����豸���У�����B��ˮ��Һ��CaO��Ӧ������NaOH��H2O��______��ͨ�� _________________(���������)����������ʹ��������롣
��ͼ�У���ѭ��ʹ�õ�������_______��_____________C6H6��CaO��
��2��Ϊ�˷�ֹˮԴ��Ⱦ���ü����������Եķ�������ij�����ŷŵ���ˮ�����ޱ��ӣ��˷�����____________��
�ӷ�ˮ�л��ձ��ӵķ����Ǣ����л��ܼ���ȡ��Һ�еı��ӣ��ڼ���ij��ҩƷ��ˮ��Һʹ�������л��ܼ����룻�ۼ���ij�������������ӡ���д�������������ķ�Ӧ����ʽ��_________________________��
��3��Ϊ�ⶨ��ˮ�б��ӵĺ�����ȡ�˷�ˮ100 mL�������м���Ũ��ˮ�����ٲ�������Ϊֹ���õ�����0.331 g����˷�ˮ�б��ӵĺ���____________(mg��L��1)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ѡ���л���ͬ���칹�����Ŀ�������ʽΪC5H12O�Һ����������Ĵ����л�����Ŀ��ͬ����(���������칹)��
A.����ʽΪCH2BrCl ��±����
B.����ʽΪC4H8O2����
C.![]() ��һ�����
��һ�����
D.������(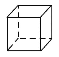 )�Ķ��ȴ���
)�Ķ��ȴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H��Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)��H2(g) ��H��Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
�¶�/�� | 400 | 500 | 850 |
ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش��������⣺
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___���÷�Ӧ��Q__0(����������������)��
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O(g)������������Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ����0��4 minʱƽ����Ӧ����v(CO)��__��

��3��400��ʱ��ѹǿ�㶨���ܱ������н���������Ӧ���ÿ��淴Ӧ�ﵽƽ��ı�־��__(����ĸ)��
A��v��(H2)��v��(CO)
B�������������������ʱ����仯
C�����������ܶȲ�����ʱ��仯
D��CO��H2O��CO2��H2�ķ�����֮��Ϊ1��1��1��1
��4������500��ʱ���У���CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020molL-1���������£�CO�����ת����Ϊ__��
��5������850��ʱ���У�ijʱ��ʱ���CO(g)��H2O(g)��CO2(g)��H2(g)�����ʵ����ֱ�Ϊ1mol��0.5mol��0.6mol��0.6mol����ʱV��__V����(��������������������=��)
��6������850��ʱ���У�����ʼʱCO��H2O(g)��Ϊ1mol������ˮ�������������Ϊx��ƽ��ʱCO��ת����Ϊy�����Ƶ�y��x�仯�ĺ�����ϵʽΪ__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com