
【题目】用下面的装置将一定量的CO2和CO的混合气体进行分离和干燥。(图中的a、b均为可以控制气体的通过和液体的加入的止水夹和活塞,实验前均已关闭,仪器的固定装置已省略)。请选择适宜的试剂,完成上述实验。可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、澄清石灰水、氢氧化钠溶液、紫色石蕊试液。
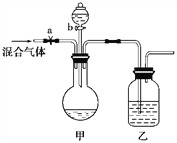
(1)甲装置的瓶中盛放的试剂是______________,分液漏斗中盛放的试剂是_____,乙装置的瓶中盛放的试剂是______________。
(2)打开a时,首先分离出的气体是________(填名称);要得到另一种气体,正确的操作是__________。
【答案】 氢氧化钠溶液 稀硫酸(或浓硫酸) 浓硫酸 一氧化碳 关闭止水夹a,打开活塞b
【解析】(1)依据实验要求可知甲、乙装置应分别为除杂和干燥装置,根据一氧化碳和二氧化碳的性质可知甲是用以吸收CO2的,因此甲、乙应分别装NaOH溶液和浓H2SO4,甲吸收CO2后生成碳酸钠,最后还应将其释放出来,从题目给出的试剂看,显然分液漏斗中盛放的是稀硫酸,稀硫酸与碳酸钠反应生成二氧化碳,不用稀盐酸是为了防止其挥发出氯化氢气体使二氧化碳不纯。故答案为:NaOH溶液;稀H2SO4;浓H2SO4;
(2)打开活塞a时,分离出来的气体是CO;要得到另一种气体时,正确的操作是关闭止水夹a,打开活塞b,换气体收集装置接收CO2,故答案为:一氧化碳;关闭止水夹a,打开活塞b。


科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图1所示.已知 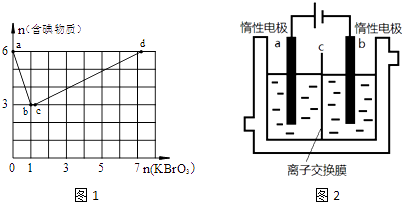
①BrO3﹣+6I一+6H+=3I2+Br﹣+3H2O;
②2BrO3﹣+I2=2IO3﹣+Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 , 还原产物是 .
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 .
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 .
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图2所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.阳极的电极反应式为;阴极观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+O2=2NO 在密闭容器中进行,下列条件哪些能增大该反应的速率(假定温度不变)( )
A.缩小容器体积,使压强增大
B.压强不变,充入N2
C.体积不变,充入He使压强增大
D.减小压强,使容器体积增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com