
| ||
| ||
 NH4-+OH-
NH4-+OH- NH4-+OH-
NH4-+OH-
| ||
| ||
 NH4-+OH-,故答案为:NH3?H2O
NH4-+OH-,故答案为:NH3?H2O NH4-+OH-;
NH4-+OH-;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-4g;0℃NH4F-100g; 常温Na2SiF6-微溶于水 |
| NH4Cl溶解度 | 33.3g | 37.2g | 41.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:上海市嘉定、黄浦区2010届高三第二次模拟考试化学试题 题型:实验题
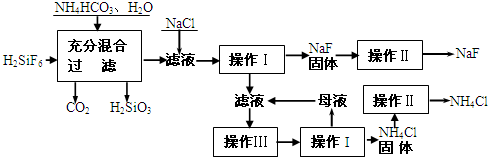
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

有关物质在水中溶解度(g/100gH2O)如下:
|
温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
|
NH4Cl溶解度 |
33.3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有 。
(2)上述流程中发生两步反应,化学方程式为 ,
。
(3)操作II的作用是 ,
操作Ⅲ的具体过程是 。
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三第三次考试化学试卷 题型:填空题
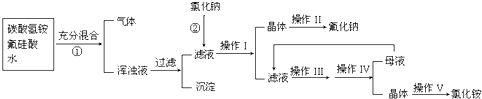
(15分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度(g/100gH2O)如下:
|
温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
|
NH4Cl溶解度 |
33.3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有 。
(2)上述流程中发生两步反应,化学方程式为:
(3)操作II的作用是
操作Ⅲ的具体过程是
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com