
| A、此时反应物B全部转化成了生成物 |
| B、单位时间内生成n mol A,同时生成4n mol C |
| C、若改变条件,A、B、C的浓度不可能再变化 |
| D、A、B、C的分子数比为1:3:4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
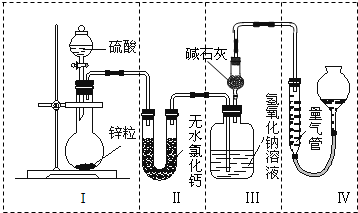 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH(OH)CH3 |
| B、CH2(OH)CH(OH)CH3 |
| C、CH3CH2CH2OH |
| D、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于可逆反应来说,反应物只有按等物质的量投料,其转化率才能相等 |
| B、AgCl悬浊液中存在平衡:AgCl(s)?Ag+ (aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C、常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ |
| D、等浓度的下列稀溶液:①硫酸氢钠、②乙酸钠、③醋酸、④碳酸氢钠、⑤硝酸钠、⑥苯酚钠,它们的PH由小到大排列的为:①③⑤②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L |
| B、0.02mol/L |
| C、0.03mol/L |
| D、0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com