
| A. | 该条件下,钠的还原性强于C | |
| B. | 若CO2过量,则有Na2CO3生成 | |
| C. | 该反应中化学能除转化为热能外,还转化为电能 | |
| D. | Na2O是离子化合物,其中离子半径:r(Na+)>r(O2-) |
分析 Na在二氧化碳中燃烧方程式为4Na+CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2O+C,
A.该反应中Na元素化合价由0价变为+1价、C元素化合价由+4价变为0价,所以Na是还原剂、C是还原产物,同一氧化还原反应中还原剂的还原性大于还原产物的还原性;
B.二氧化碳是酸性氧化物、氧化钠是碱性氧化物,二者发生反应生成盐;
C.该反应中化学能转化为热能,没有转化为电能;
D.氧化钠中只含离子键,电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:Na在二氧化碳中燃烧方程式为4Na+CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2O+C,
A.该反应中Na元素化合价由0价变为+1价、C元素化合价由+4价变为0价,所以Na是还原剂、C是还原产物,同一氧化还原反应中还原剂的还原性大于还原产物的还原性,所以还原性Na>C,故A正确;
B.二氧化碳是酸性氧化物、氧化钠是碱性氧化物,二者发生反应生成盐,所以过量的二氧化碳和氧化钠反应生成碳酸钠,故B正确;
C.该反应中钠燃烧放出热量,没有形成原电池,所以该反应中有化学能转化为热能,没有转化为电能,故C错误;
D.氧化钠由钠离子和氧离子构成,为离子化合物,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:r(Na+)<r(O2-),故D错误;
故选CD.
点评 本题以钠为载体考查氧化还原反应、基本概念、能量转化、元素周期律等知识点,为高频考点,明确基本概念、元素周期律内涵等知识点是解本题关键,知道离子半径大小比较方法,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水的离子积常数(KW)随溶液浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯属于芳香烃,它的官能团是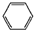 | |
| B. | 分子结构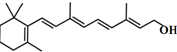 是维生素A的键线式 是维生素A的键线式 | |
| C. | 氯溴碘代甲烷的同分异构体数目有两个,就像人的左右手似的 | |
| D. | 乙醇与二甲醚互为同分异构体,这种同分异构现象叫官能团异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法的名称为2-甲基-3,5-二乙基乙烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 下列物质的沸点按由低到高顺序为:CH3(CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应选用球形分液漏斗进行分液,使用前要检查是否漏水 | |
| B. | 将混合液倒入分液漏斗,塞紧玻璃塞,上下振荡 | |
| C. | 混合液摇匀后,立即将分液漏斗放在铁圈上静置,分层 | |
| D. | 打开分液漏斗的玻璃塞,再打开旋塞,使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
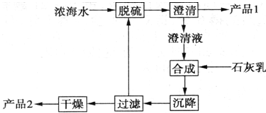 将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Mg2+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com