
某白色粉末由碳酸钠、硝酸镁、硫酸铜、氯化钾、氯化铵中的一种或几种组成。为了检验它们所含的物质,做了以下实验。①取部分粉末,加水溶解,得无色溶液。将所得溶液分成两份,分别进行实验;②在第一份溶液中滴加足量稀盐酸,有气泡产生,继续往反应后的溶液中滴加AgNO3溶液有白色沉淀生成;③在第二份溶液中滴加氢氧化钠溶液并加热,将湿润的红色石蕊试纸放在试管口,试纸变蓝。由此可判断固体混合物中肯定含 (写化学式,下同),肯定没有 ,可能含有 。对可能有的物质,可采用 来检验,如果含有该物质,其现象是 。步骤③中有关的化学方程式为: 。
科目:高中化学 来源: 题型:填空题
综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如下图所示: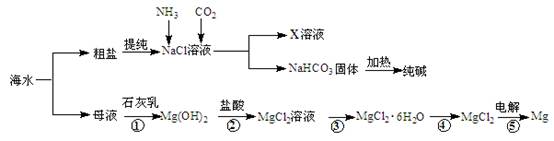
(1)反应①~⑤中,属于氧化还原反应的是 (填编号)。
(2)写出反应②的离子方程式 。
(3)X溶液中的主要阳离子是Na+和 。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③ ;④加适量盐酸;⑤ 。(请补全缺少的实验步骤)
(5)检验纯碱样品中是否含NaCl应选用的试剂是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):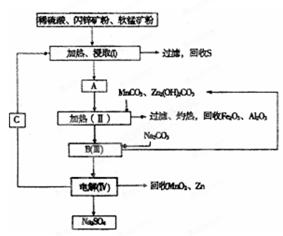
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解方程式为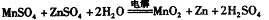
(1)A中属于还原产物的是_____。
(2)加人MnCO3、Zn2(OH)2CO3的作用是_________________;II需要加热的原因是:______ ;C的化学式是_________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_____。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工 原料是_______。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进 行的操作有蒸发浓缩、 、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
自然界中的物质多数是以混合物的形式存在,下面是混合物的分离和提纯,请填空:
(1)除去NaCl固体中混有的少量CaCO3,所进行的实验操作为: 、 、蒸发、结晶。
(2)除去NaCl中的Na2SO4,依次加入的溶液为(填溶质化学式): 、 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)用CCl4提取溴水中的溴,可采用 的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用 和 的方法除去。
(4)除去氧化钙中的碳酸钙可用 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙 ;
(2)分离四氯化碳与水的混合物 ;
(3)分离汽油和煤油 ;
(4)分离碘水中的碘单质 ;
(5)KNO3晶体中含有少量食盐 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题:
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)某物质用途广泛,可用作分析试剂、媒染剂、催化剂及化工原料。经测定它含有铁元素,摩尔质量为482g/mol。为进一步确定它的组成,某化学兴趣小组做了以下实验:
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
| A.补血剂 | B.净水剂 | C.含酚废水的检测试剂 | D.肥料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com