
【题目】下列有关实验操作、现象、目的及结论都正确的是
选项 | 实验 | 现象结论 |
A | 向浓度均为 0.1 molL1 NaCl 和 Na2CrO4混合溶液中滴加0.1 molL1 AgNO3 溶液,先生成白色的AgCl沉淀 | 能证明Ksp(AgCl)< Ksp(Ag2CrO4) |
B | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 | 不能区别植物油和矿物油 |
C | 其他条件相同,一只试管中加入5mL 0.2mol/LH2C2O4 (aq)和2.5L 0.1mol/L KMnO4(aq);另一支试管中加入7.5ml 0.2moI/L H2C2O4 (aq)和 2.5mL 0.2mol/L KMnO4(aq) 和5mlH2O | 可验证相同条件下浓度对化学反应速率的影响 |
D | 常温下,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH | 能证明酸性:HA>H2CO3 |
A. A B. B C. C D. D
【答案】C
【解析】
A.向浓度均为 0.1 molL1 NaCl 和 Na2CrO4混合溶液中滴加0.1 molL1 AgNO3 溶液,先生成白色的AgCl沉淀,可以证明氯化银的溶解度小于铬酸银,但是因为两者的组成和结构不同,所以不能证明Ksp(AgCl)< Ksp(Ag2CrO4),故A错误;B.植物油属于酯类化合物,加入烧碱溶液加热,会发生水解生成羧酸和醇,在冷却后不分层,矿物油属于烃类化合物,加入烧碱溶液加热,不反应,冷却后观察能分层,所以用烧碱溶液能区别植物油和矿物油,故B错误;C. 其他条件相同,一只试管中加入5mL 0.2mol/LH2C2O4 (aq)和2.5mL 0.1mol/L KMnO4(aq);另一支试管中加入7.5mL0.2moI/L H2C2O4 (aq)和 2.5mL 0.2mol/L KMnO4(aq) 和5mlH2O, 因为所加草酸的浓度不同,所以可验证相同条件下浓度对化学反应速率的影响。故C正确;D.因为Na2CO3溶液的水解是分步进行的,以第一步为主,即CO32-+H2O![]() HCO3-+OH-,NaA的水解的离子方程式为A-+H2O
HCO3-+OH-,NaA的水解的离子方程式为A-+H2O![]() HA+OH-,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH,只能证明HA的酸性强于HCO3-,不能证明酸性:HA>H2CO3,故D错误;答案:C。
HA+OH-,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH,只能证明HA的酸性强于HCO3-,不能证明酸性:HA>H2CO3,故D错误;答案:C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某装有红色溶液的试管,加热时溶液颜色逐渐变浅,则原溶液可能是
①滴有酚酞的氨水溶液 ②滴有酚酞的氢氧化钠溶液
③溶有SO2的品红溶液 ④滴有酚酞的饱和氢氧化钙溶液
⑤酚酞溶液中滴加少量NaClO溶液
A. ①④⑤ B. ①③ C. ③④⑤ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中会导致结果偏高的是 ( )
① 配制稀H2SO4时,洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
② 配制溶液时,未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中定容
③ 酸碱中和滴定时,盛装标准液的滴定管用蒸馏水洗净后,直接加入标准液
④ 酸碱中和滴定时,滴定前没有排除滴定管尖嘴处的气泡
⑤ 配制溶液时,转移前,容量瓶中含有少量蒸馏水
⑥ 配制溶液时,定容摇匀后,发现液面低于刻度线
⑦ 配制溶液时,定容时,俯视刻度线
A. ①②③④⑦ B. ①②④⑥⑦ C. ①②⑤⑦ D. ①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g) + 1/2 O2(g) ![]() H2O(l) △H=-300KJ·mol-1
H2O(l) △H=-300KJ·mol-1
C3H8(g) + 5O2(g) ![]() 3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热5000KJ,则混合气体中氢气和丙烷的体积比约为( )
A. 7:10B. 3:1C. 10:7D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质的结构简式如图所示,下列有关该物质的说法不正确的是( )

A. 该物质的分子式为C13H16N2O5
B. 该物质是由两分子不同的氨基酸经脱水缩合而得
C. 该物质属于蛋白质
D. 1 mol该物质最多可与2 mol NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的产物并不改变的是( )
A.Na和O2B.NaOH和CO2
C.Na2O2和CO2D.Na2CO3和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将 aLHCl完全溶于 1 L 水中 ( 水的密度近似为 1 g / mL) ,溶液的密度为 d g/cm 3,溶液的体积为V mL,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L 。下列叙述中不正确的是( )
A. ω =![]() ×100%
×100%
B. c =![]() mol/L
mol/L
C. 所得溶液中含有HCl分子
D. 向上述溶液中再加入V mL 水后,所得溶液的质量分数大于 0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中
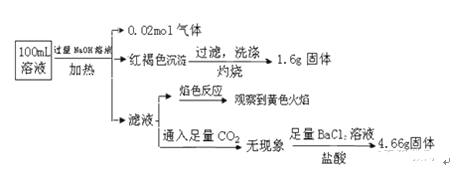
A. 溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 molL﹣1
B. 原溶液中c(Fe3+)=0.2 molL﹣1
C. SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D. 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com