
下列说法正确的是
A.平衡膳食就是各种食物都要吃
B.摄入食物中的营养素种类齐全,数量充足,比例适当且与人体的需要的保持平衡才是合理的膳食结构
C.淀粉、油脂、蛋白质为人体提供热能,所以人体只要这三种物质摄入量足够就可以了
D.为维持人体内电解质平衡,人在大量出汗后应及时补充Ca2+离子
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是__________________________________________。
(2)方案二:按如图所示装置进行实验。并回答以下问题:
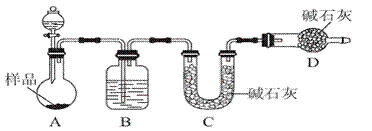
①实验前应先______________________________________________。
分液漏斗中应该装________(填“盐酸”或“稀硫酸”)。D装置的作用是_____________________________________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_________________________;
②实验中判断沉淀是否完全的方法是_________________________________________;
③若加入试剂改为氢氧化钡,已知称得样品9.5 g,干燥的沉淀质量为19.7 g,则样品 中碳酸钠的质量分数为 (保留一位小数)。
中碳酸钠的质量分数为 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 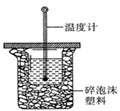 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越
越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
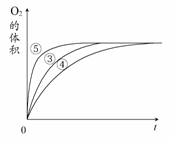
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A.植物油不能使溴水褪
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)淀粉的化学式是 ;玻璃、陶瓷、水泥一定含 元素。造成赤潮的主要元素
是 ;油脂在体内水解后的产物是 和高级脂肪酸。
(2)常见的塑料有两类,一类是 塑料,如聚乙烯,一类是 塑料,如酚醛树脂等。
硫化后的橡胶适合制造汽车轮胎,加入 可增强轮胎的耐磨性。
(3)在“棉花、尼龙、黏胶纤维、蚕丝”这四中纤维中,属于天然纤维的是 ;属于
人造纤维的是 ;属于合成纤维的是 。
(4)药品标签上应贴有 “OTC”或“R”符号,①“OTC”它表示 ,②“R”表示 ,
氢氧化铝和碳酸氢钠都可用作抗胃酸药。写出:
③氢氧化铝与胃酸作用的离子方程式: ;
④碳酸氢钠与胃酸作用的化学方程式: 。
(5)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而
是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+
的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
①往KMnO4溶液中滴入维生素C溶液,KMnO4溶液褪色说明维生素C具有 性,
②人体长期缺乏维生素C会引起 病,
③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下
转化成亚铁盐。此反应的离子方程式为
(6)我国城市为了减少燃煤造成的大气污染,对民用燃料的煤作了多方面的改进。
①绿色能源是人类的理想能源不会造成环境污染,下列能源不属于绿色能源的是
A.氢能源 B.太阳能 C.风能 D.石油
②为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反
应:FeS2+14FeCl3+8H2O===2FeSO4+13FeCl2+16HCl 该反应中的氧化剂是 ;
为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新
利用生成FeCl3。请写出这一过程中有关的离子方程式:
、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2 下列说法正确的是:
A、在常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数
B在常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17 mol2·L-2
C常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L
D、向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com