
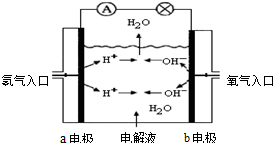
 图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:

科目:高中化学 来源: 题型:
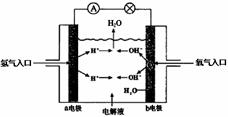 如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式
如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式查看答案和解析>>
科目:高中化学 来源: 题型:
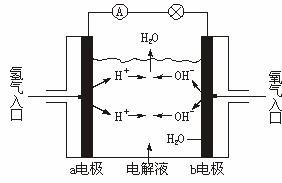
A.a电极是负极
B.b电极的电极反应为:4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是
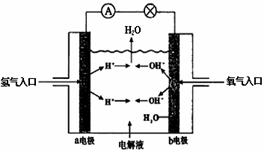 A、a电极是负极
A、a电极是负极
B、b电极的电极反应为:
4OH--4 e-=2H2O +O2
C、电池工作时,电子由正极通过外电路流向负极
D、氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com