
分析 (1)根据n=$\frac{m}{M}$计算;
(2)根据方程式求出HCl的物质的量,再求溶液的体积;
(3)根据方程式求出CO2的物质的量,再根据V=nVm计算.
解答 解:(1)10g CaCO3的物质的量为n=$\frac{m}{M}$=$\frac{10g}{100g/mol}$=0.1mol;
答:10g CaCO3的物质的量为0.1mol;
(2)已知发生的反应为:2HCl+CaCO3=CaCl2+H2O+CO2↑,
则消耗的HCl的物质的量为n(HCl)=2n(CaCO3)=0.2mol,
则V(HCl)=$\frac{0.2mol}{2mol/L}$=0.1L;
答:参加反应盐酸溶液的体积0.1L;
(3)由方程式可知CO2的物质的量为n(CO2)=n(CaCO3)=0.1mol,
生成CO2的体积(标况下)为V=nVm=0.1mol×22.4L/mol=2.24L;
答:生成CO2的体积(标况下)为2.24L.
点评 本题考查根据方程式进行的计算,比较基础,侧重于考查学生的分析能力和计算能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
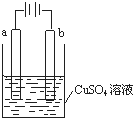
| A. | 若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-═Cu | |
| B. | 若a和b为铜,通电后a电极有气体产生 | |
| C. | 若a为铜,b为铁,通电后Cu2+向a电极移动 | |
| D. | 若a为粗铜,b为纯铜,通电后b电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2H2$\stackrel{一定条件}{→}$
+2H2$\stackrel{一定条件}{→}$ .
. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 神舟七号返回舱约3吨多重,是世界上现有的最大的返回舱.为了防止飞船与大气摩擦产生高温而起火燃烧,在飞船表面覆盖着某种特殊材料,该材料应具有的性质是( )
神舟七号返回舱约3吨多重,是世界上现有的最大的返回舱.为了防止飞船与大气摩擦产生高温而起火燃烧,在飞船表面覆盖着某种特殊材料,该材料应具有的性质是( )| A. | 良好的导电性 | |
| B. | 密度较大,以增大飞船对地面的惯性 | |
| C. | 轻质防热,可以承受上千度的高温 | |
| D. | 质地柔软,以利于飞船变形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7的溶液中:Na+、K+、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$ | |
| B. | 无色透明溶液中:H+、Ca2+、Cl-、AlO2- | |
| C. | 含大量Fe3+的溶液中:K+、I-、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 与Al反应放出H2的溶液中:NH${\;}_{4}^{+}$、Na+、NO${\;}_{3}^{-}$、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,二氯甲烷的结构式
,二氯甲烷的结构式 ,写出CH3(CH2)5CH3的名称:正庚烷.戊烷三种同分异构体的结构简式:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4.
,写出CH3(CH2)5CH3的名称:正庚烷.戊烷三种同分异构体的结构简式:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com