
| A、FeCl2 |
| B、AlCl3 |
| C、MgCl2 |
| D、CuCl2 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
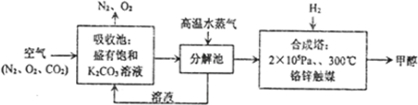
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
| 3 | 900 | a | b | c | d | - |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用惰性电极电解MgCl2 溶液:2Cl-+2H2O
| ||||
| B、用浓盐酸酸化的高锰酸钾溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| C、向NH4Al(SO4)2溶液中逐滴加入过量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3?H2O | ||||
| D、向澄清石灰水中滴加同浓度的少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为: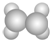 ; ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为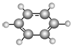 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为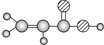 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A、在AgCl,Ag2SO4,AgBr,AgI饱和溶液中分别滴加Na2S溶液现象相同 |
| B、25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4 |
| C、25℃时,在等物质的量浓度NaCl的溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中溶液积相同,但c(Ag+)不同 |
| D、AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | X | Y | Z | 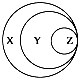 |
| A | 胶体 | 混合物 | 淀粉溶液 | |
| B | 化合物 | 酸性氧化物 | 一氧化氮 | |
| C | 气态氢化物 | 化合物 | 液溴 | |
| D | 强电解质 | 强酸 | 硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
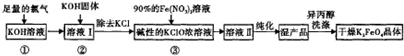
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com