


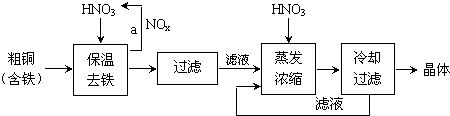
���� ��1�����ݵ��װ�ã�Zn��������CΪ������������ص������Ժ�ǿ�������ϸ�����ط�����ԭ��Ӧ����Fe��OH��3�����ݵ���ת�Ƽ���Zn��������
��2�����ſ���ƽ���ɣ����������ƶ����������������ƶ���
��3����ͼ��֪������ص��ŵ��У�ʹ��ʱ�䳤��������ѹ�ȶ���
���Ȼ�����Һ�м���������ƺ��������ƣ�������ӦΪ��2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O����Na2FeO4�ֲ�Ʒ��40%KOH��Һ���ܽ⣬���˳�ȥ����NaCl�����뱥��KOH��Һ��Na2FeO4ת��Ϊ�ܽ�ȸ�С��K2FeO4����Ӧ����ʽΪNa2FeO4+2KOH=K2FeO4+2NaOH����ȴ�ᾧ�����ˣ��������������ˮ��������������������������ˮϴ�Ӳ�Ʒ���Լ��ٸ�����ص���ģ�ͬʱϴȥ������ؾ�������KOH���������ʣ��õ�����Ʒ������أ�
��4������FeԪ�ػ��ϼ���+3������Ϊ+6�ۣ�������3�ۣ�ClԪ�ػ��ϼ���+1�۽���Ϊ-1���ۣ�������2�ۣ����ϼ�������С������Ϊ6����FeCl3��ϵ��Ϊ2��NaClO��ϵ��Ϊ3���ٸ���ԭ���غ���ƽ������Ԫ�ػ��ϼ۽��͵ķ�Ӧ������������
��5�����뱥��KOH��Һ��������K+��Ũ�ȣ���С������ص��ܽ⣬�ٽ�������ؾ���������
��6������Ksp[Fe��OH��3]=c��Fe3+����c3��OH-��=4.0��10-38���㿪ʼ����ʱc��OH-�����ٸ���ˮ�����ӻ�������Һ��c��H+��������ϡ�Ͷ��ɼ�����Ҫ����������
��� �⣺��1�����ݵ��װ�ã�Zn��������CΪ������������ص������Ժ�ǿ�������ϸ�����ط�����ԭ��Ӧ����Fe��OH��3�������缫��ӦʽΪ��FeO42-+4H2O+3e-�TFe��OH��3��+5OH-����ά�ֵ���ǿ��Ϊ1A����ع���ʮ���ӣ�ͨ������Ϊ$\frac{1A��600s}{96500C/mol}$������������ZnΪ$\frac{1A��600s}{96500C/mol}$��$\frac{1}{2}$��65g/mol=0.2g��
�ʴ�Ϊ��FeO42-+4H2O+3e-�TFe��OH��3��+5OH-��0.2��
�ʴ�Ϊ��FeO42-+4H2O+3e-�TFe��OH��3��+5OH-��0.2��
��2�������������������ƶ����������������ʹ������������һ��ͨ·��ʹ����Һ���ֵ����ԣ���ƽ���ɣ����ɱպϻ�·���ŵ�ʱ�����������������ƶ�����ij�ָ߷��Ӳ����Ƴ������ӽ���Ĥ�������ţ�������������ƶ���
�ʴ�Ϊ���ң���
��3����ͼ��֪������ص��ŵ��У�ʹ��ʱ�䳤��������ѹ�ȶ���
�ʴ�Ϊ��ʹ��ʱ�䳤��������ѹ�ȶ���
���Ȼ�����Һ�м���������ƺ��������ƣ�������ӦΪ��2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O����Na2FeO4�ֲ�Ʒ��40%KOH��Һ���ܽ⣬���˳�ȥ����NaCl�����뱥��KOH��Һ��Na2FeO4ת��Ϊ�ܽ�ȸ�С��K2FeO4����Ӧ����ʽΪNa2FeO4+2KOH=K2FeO4+2NaOH����ȴ�ᾧ�����ˣ��������������ˮ��������������������������ˮϴ�Ӳ�Ʒ���Լ��ٸ�����ص���ģ�ͬʱϴȥ������ؾ�������KOH���������ʣ��õ�����Ʒ������أ�
��4������FeԪ�ػ��ϼ���+3������Ϊ+6�ۣ�������3�ۣ�ClԪ�ػ��ϼ���+1�۽���Ϊ-1���ۣ�������2�ۣ����ϼ�������С������Ϊ6����FeCl3��ϵ��Ϊ2��NaClO��ϵ��Ϊ3���ٸ���ԭ���غ���ƽ��Ӧ����ʽΪ��2FeCl3+10NaOH+3NaClO�T2Na2FeO4+9NaCl+5H2O��NaClO����������
�ʴ�Ϊ��2��10��3��2��9��5��NaClO��
����Ԫ�ػ��ϼ۽��͵ķ�Ӧ������������
��5�����뱥��KOH��Һ��������K+��Ũ�ȣ���С������ص��ܽ⣬�ٽ�������ؾ���������
�ʴ�Ϊ����С������ص��ܽ⣬�ٽ�������ؾ���������
��6����Һ��c��Fe3+��=5mol/L������Ksp[Fe��OH��3]=c��Fe3+����c3��OH-��=4.0��10-38����֪��ʼ����ʱc��OH-��=2��10-13mol/L������Һ��c��H+��=$\frac{1{0}^{-14}}{2��1{0}^{-13}}$mol/L=0.05mol/L������ϡ�Ͷ��ɣ���Ҫ��������Ϊ$\frac{0.05mol/L��100mL}{2mol/L}$=2.5mL��
�ʴ�Ϊ��2.5��
���� ���⿼��ԭ��ع���ԭ���������Ʊ��������̣����ؿ��������Ʊ������ķ���Ӧ�ã������������ʺ�ƽ���ƶ�ԭ���Լ���ѧ��ع���ԭ���ǽ���ؼ�����1���е缫��Ӧʽ��дΪ�ѵ㣬��ĿӦ�ø���һ������Ϣ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ����ɫ��dz��ɫ��˵����ˮ�к���Cl2 | |
| B�� | ����ˮ�еμ������ữ��AgNO3��Һ��������ɫ������˵����ˮ�к���Cl- | |
| C�� | ����ˮ�м���NaHCO3��ĩ�������ݲ�����˵����ˮ�к���H+ | |
| D�� | ��FeCl2��Һ�еμ���ˮ����Һ��ɫ����ػ�ɫ��˵����ˮ�к���HClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
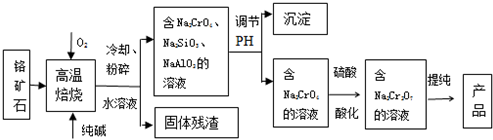
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭ��Ʒ���ܷ���������ʴ���ܷ������ⸯʴ | |
| B�� | ����Ʒ���ڱ��������ܵ�����Ĥ�������ȶ������ڿ����� | |
| C�� | ƻ�����ڿ����о��ñ�ƺ�Ư��ֽ�ž��ñ��ԭ������ | |
| D�� | �ߴ��ȵ�SiO2�Թ��кܺõ������ȫ�������ã������Ƴɹ��ؽ�����ֱ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
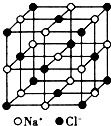 ���Ƿǽ�������ǿ��Ԫ�أ�
���Ƿǽ�������ǿ��Ԫ�أ�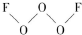 ��������ԭ�Ӳ��õĹ���ӻ���ʽ��sp3������O2F2��һ��ǿ������������VSEPRģ���ж�O2F2�Ǽ��ԣ�����ԡ��Ǽ��ԡ������ӣ�
��������ԭ�Ӳ��õĹ���ӻ���ʽ��sp3������O2F2��һ��ǿ������������VSEPRģ���ж�O2F2�Ǽ��ԣ�����ԡ��Ǽ��ԡ������ӣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
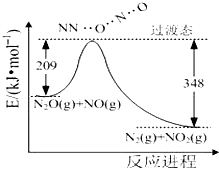 ���Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ��ش��������⣺
���Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ��ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com