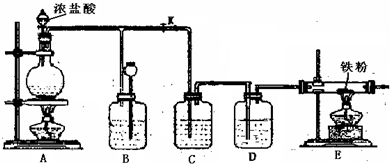
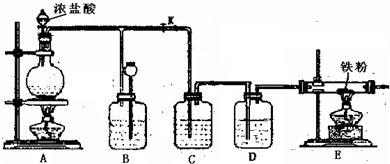
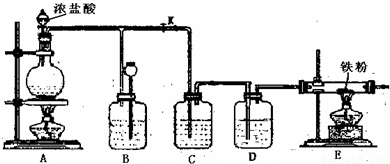
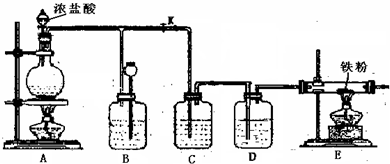
解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水.
故答案为:MnO
2+4H
++2Cl
-(浓)

Mn
2++Cl
2↑+2H
2O
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢;氯化氢极易溶于水;氯气和水反应方程式为
Cl
2+H
2O

HCl+HClO,食盐溶于水后电离出氯离子,抑制氯气和水反应,降低氯气的溶解度,所以选饱和食盐水.
故答案为:饱和食盐水.
因为题中要求制取纯净的无水CuCl
2,所以要除去氯气中混有的水蒸气,且不引进新的杂质、氯气也和该物质不反应,所以选浓硫酸.故答案为:浓硫酸.
(3)氯气具有强氧化性,能把变价金属氧化成最高价态.
故答案为:2Fe+3Cl
2
2FeCl
3(4)因为A处仍有少量Cl
2产生,氯气通过导管进入B装置,所以在B液面上方有黄绿色气体,导致B装置中压强增大;压强增大导致B装置中的液体进入长颈漏斗中;所以B处的作用是可以使内压降低,充当储气瓶.
故答案为:B中液面下降,长颈漏斗内液面升高,B中液面上方有黄绿色气体; 可以使内压降低,充当储气瓶.
(5)氯气有毒,污染环境,所以不能直接排空,应该有尾气处理装置;因为氯气和水反应产生酸,酸能和碱反应,所以可用碱液吸收氯气.
故答案为:否; 或用NaOH溶液处理尾气.
分析:(1)根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式;
(2)根据浓盐酸的性质及反应方程式确定混合气体的成分,根据氯化氢、氯气的性质确定试剂名称;
根据题目要求结合反应方程式中的生成物判断C处盛放的试剂名称;
(3)根据氯气的性质判断生成物,从而写成反应方程式;
(4)根据容器内压强判断现象;从而确定B的作用;
(5)根据氯气的性质判断;
点评:解答时注意:
1、浓盐酸的浓度不是很大,在溶液中存在的微粒是离子,所以写离子方程式时浓盐酸要写离子不能写分子式,而浓硫酸写分子式.
2、氯气具有强氧化性,能把变价金属氧化成最高价态.

 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O HCl+HClO,食盐溶于水后电离出氯离子,抑制氯气和水反应,降低氯气的溶解度,所以选饱和食盐水.
HCl+HClO,食盐溶于水后电离出氯离子,抑制氯气和水反应,降低氯气的溶解度,所以选饱和食盐水. 2FeCl3
2FeCl3