
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
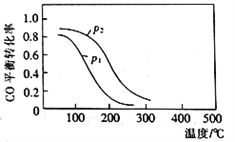
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大 b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度 d.图中压强p1<p2
③200℃时,该反应的平衡常数K =_______。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
(4)有人设计将两根 Pt 丝作电极插入 KOH 溶液中,然后向两极上分别通入乙醇和氧气而 构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:_____________
正极:_____________
【答案】-a+3b+c–d<cd6.2560%C2H5OH+16OH--12e-=2CO32-+11H2OO2+4e-+2H2O=4OH-
【解析】
(1) CH4(g)+H2O(g)=CO(g)+3H2(g)△H1,已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;②H2O (l) =H2O(g); △H=+dkJmol-1,由盖斯定律可知△H1=-a+3b+c–d kJmol-1,故答案为:-a+3b+c–d;
(2)①由图示可知在恒压条件下,随着温度的升高CO的转化率降低,说明升高温度平衡逆向移动,即正反应为放热反应,△H2<0,故答案为:<;
②a、正方向为放热反应,升高温度平衡逆向移动,平衡常数减小,故a错误;b.达平衡后再充入稀有气体,压强增大,但平衡不移动,CO的转化率不变,故b错误;c.CH4(g)+H2O(g)=CO(g)+3H2(g),达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,故c正确;d.、由图示可知,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,故d正确;故答案为:cd;
③由图表可知,3min后反应达到平衡状态
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol·L-1) 0.4 0.8 0
变化浓度(mol·L-1) 0.2 0.4 0.2
起始浓度(mol·L-1) 0.2 0.4 0.2
200℃时,200℃时平衡常数K=c(CH3OH)/(c(CO)×c2(H2))=0.2/(0.2×0.42)=6.25;故答案为:6.25;
(3)甲烷、氧气和KOH溶液可组成燃料电池,CH4完全氧化后的产物为K2CO3,1mol甲烷完全燃烧转移电子的物质的量为[4-(-4)]mol=8mol。测得电路中转移1.2 mol电子,可知参加反应的甲烷为1.2mol/8mol ×1mol=0.15mol,标准状况下通入5.6 L甲烷的物质的量为5.6L/22.4L·mol-1=0.25mol,甲烷的利用率为0.15mol/0.25mol ×100%=60%,故答案为:60%;
(4)在燃料电池的负极发生氧化反应,通入的是乙醇,电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O;正极发生还原反应,通入的是氧气,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:C2H5OH+16OH--12e-=2CO32-+11H2O、O2+4e-+2H2O=4OH-。


科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 图①表示不同压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
B. 图②表示向10ml0.1mol·L-1Na2CO3和NaHCO3两种溶液中分别滴加0.lnol·L-1HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液
C. 图③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液
D. 图④表示该反应为放热反应,且催化剂能改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B. 若2C(s) + O2(g) = 2CO(g) △H=—221.0kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 电解水可以获得H2和O2,该反应是放热反应
D. 已知I:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol,II:![]() 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为2(a+b+c) kJ/mol
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为2(a+b+c) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
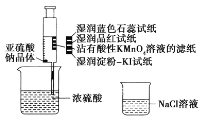
A. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
B. 蓝色石蕊试纸先变红后褪色
C. NaCl溶液可用于除去实验中多余的SO2
D. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应NO+CO2![]() CO+NO2在密闭容器中进行,下列哪些条件会使平衡发生移动:( )
CO+NO2在密闭容器中进行,下列哪些条件会使平衡发生移动:( )
A. 缩小体积使压强增大 B. 压强不变,充入N2使体积增大
C. 体积不变充入CO2使压强增大 D. 体积不变,充入H2使压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)![]() 2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.a1、a2均减小 B.a1减小,a2增大
C.a1不变,a2增大 D.a1不变,a2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,
V(A) = V(B) = a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
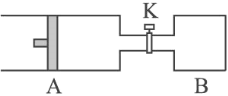
A. n(Z)B = 2n(Z)A
B. A容器中X的转化率为20%
C. 若向A和B中均再加入1molX和1molY,X的体积分数均增大
D. 打开K保持温度不变,又达到平衡时,A的体积为3.3a L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法不正确的是( )

A. 元素b的单质不能与酸性氧化物发生化学反应
B. a、b、d、f四种元素的离子半径:f>d>a>b
C. 元素c的氧化物既能与酸反应又能与碱反应
D. a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com