
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
【答案】BD
【解析】由表格中数据,400℃时I中,
2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始物质的量(mol) 0.2 0.2 0 0
转化物质的量(mol)0.12 0.12 0.060.12
平衡物质的量(mol)0.08 0.08 0.06 0.12
K=![]() =21.09,以此解答。
=21.09,以此解答。
详解: A. 容器I中达到平衡所需时间2s,则v(N2)=![]() =0.03 molL-1·s-1,故A错误;
=0.03 molL-1·s-1,故A错误;
B.该反应为气体体积减小的反应,则ΔS<0,I与III比较,III极限转化为反应物时,起始量相同,温度低时N2的平衡浓度大,可以知道降低温度平衡正向移动,正反应为放热反应,即ΔH<0,所以B选项是正确的;
C.I与II比较,温度相同、起始量为2倍关系,但II中压强大、平衡正向移动,则达到平衡时,体系中![]() 关系: c(CO,容器II)<2c(CO,容器I),故C错误;
关系: c(CO,容器II)<2c(CO,容器I),故C错误;
D.起始时向I中充入NO、CO、N2、CO2各0.1mol,QC=![]() =10<K,平衡正向移动,开始时V正>V逆,所以D选项是正确的。
=10<K,平衡正向移动,开始时V正>V逆,所以D选项是正确的。
所以BD选项是正确的。


科目:高中化学 来源: 题型:
【题目】化学使生活更美好,下列认识不合理的是( )
A.垃圾分类回收有利于保护环境、节约资源
B.大力推广公共交通使用新能源汽车
C.研制合成新药物为生命健康提供保障
D.制作计算机芯片的材料硅是一种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是
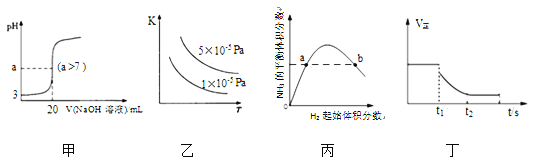
A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B. 图乙表示2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K与温度和压强的关系
2SO3(g) △H<0的平衡常数K与温度和压强的关系
C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D. 图丁表示反应 2SO2+O2 ![]() 2SO3,t1 时刻降低温度符合图示变化
2SO3,t1 时刻降低温度符合图示变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行的反应:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) △H。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③),测得CO2平衡转化率与温度关系如下图所示,下列有关说法不正确的是
C2H5OH(g)+3H2O(g) △H。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③),测得CO2平衡转化率与温度关系如下图所示,下列有关说法不正确的是
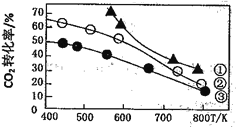
A. 该反应:△H<0
B. 氢碳比:①>②>③
C. 其它条件不变的情况下,加入无水氯化钙CO2的转化率降低
D. 若起始CO2浓度为2mol·L一1、H2为4mol.L一1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.69
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
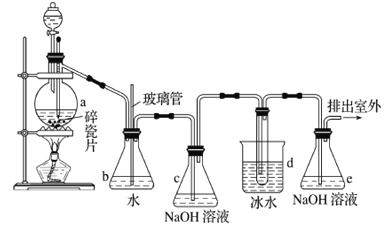
已知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升高到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是_______________________________________________;安全瓶b还可以起到的作用是__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
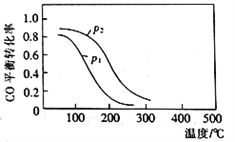
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大 b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度 d.图中压强p1<p2
③200℃时,该反应的平衡常数K =_______。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
(4)有人设计将两根 Pt 丝作电极插入 KOH 溶液中,然后向两极上分别通入乙醇和氧气而 构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:_____________
正极:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是
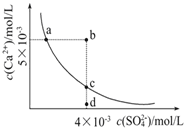
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
A. 2句 B. 3句 C. 4句 D. 5句
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com