


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
 B3N3H6是一种平面形分子(如图所示),因其分子结构的特殊性,被称为无机苯,“无机苯”的二氯代物的同分异构体的种类一共有( )
B3N3H6是一种平面形分子(如图所示),因其分子结构的特殊性,被称为无机苯,“无机苯”的二氯代物的同分异构体的种类一共有( )| A、3种 | B、4种 | C、5种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| B、室温下,pH=12的NaOH溶液和pH=2的醋酸溶液等体积混合后,溶液呈酸性 |
| C、1 L 1 mol?L-1的Na2CO3溶液中CO32-的数目为NA |
| D、电解饱和食盐水,当阴极在标准状况下产生2.24L氢气时,转移的电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、氨水与盐酸反应:OH-+H+═H2O |
| C、氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| D、氢氧化钠溶液和碳酸氢钠溶液反应:OH-+HCO3-═H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素原子的最外层电子数为4 |
| B、其常见价态为+2、+4 |
| C、它的金属性比铅强 |
| D、它的原子半径比第115号元素的原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:
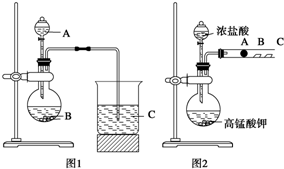 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com