
【题目】电石中的碳化钙和水能完全反应![]() ,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从从上到下,从左到右直接连接的顺序(填各仪器,导管的序号) 接 接 接 接 接 。_________
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次)
①称取一定量电石,置于仪器3中,塞紧橡皮塞
②检查装置的气密性
③在仪器6和5中注入适量水
④待仪器3恢复至室温时,量取仪器4中水的体积(导管2中水的体积忽略不计)
⑤慢慢开启仪器6 的活塞,使水逐滴滴下至不发生气体时,关闭活塞。
正确操作顺序(用操作编号填写)是____________________________
(3)若实验中产生的气体存在难闻的气味,且测定结果偏大,这是因为电石中含有杂质气体,可以用___________________(填试剂)加以除去。
【答案】6-3-1-5-2-4 ②①③⑤④ CuSO4或NaOH溶液
【解析】
(1)制备气体并测量气体体积时一般包括发生装置、排水收集装置和接水装置,据此分析解答;
(2)制备气体时并测量气体实验步骤需要:检验气密性→装药品→发生反应→量取体积的步骤操作,据此分析解答;
(3)生成的乙炔气体中含有硫化氢气体,结合硫化氢的性质分析解答。
(1)本实验仪器的连接顺序应按照发生装置(3和6)、排水收集装置(5)和接水装置(4)连接,连接时要考虑排水集气瓶(即5)中的两个导管应短进长出,故答案为:6-3-1-5-2-4;
(2)本实验操作按照检查装置的气密性→装药品→发生反应→量取体积的步骤操作,加入药品时应先加固体再加液体,故答案为:②①③⑤④;
(3)生成的乙炔气体中往往含有硫化氢等气体,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应,因此可以用硫酸铜溶液或氢氧化钠溶液除去,故答案为:硫酸铜溶液或氢氧化钠溶液。


科目:高中化学 来源: 题型:
【题目】如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
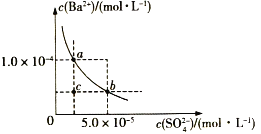
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA
B.常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA
C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物合成中间体F制备路线如下:
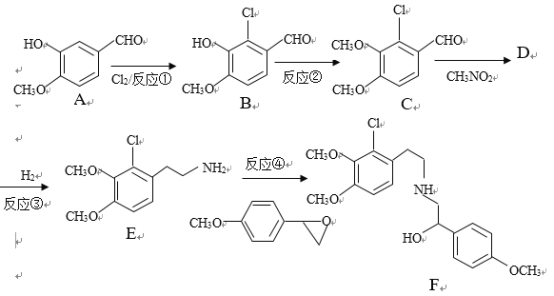
已知:RCHO+R’CH2NO2![]()
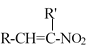 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
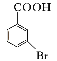 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
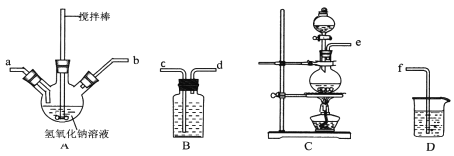
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
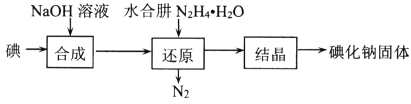
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2(反应主要装置如图一所示,其它装置省略)。当盐酸达到一个临界浓度时,反应就会停止。为测定反应残余液中盐酸的临界浓度,探究小组同学提出了下列实验方案:
甲方案:将产生的Cl2与足量AgNO3溶液反应,称量生成的AgCl质量,再进行计算得到余酸的量。
乙方案:采用酸碱中和滴定法测定余酸浓度。
丙方案:余酸与已知量CaCO3(过量)反应后,称量剩余的CaCO3质量。
丁方案:余酸与足量Zn反应,测量生成的H2体积。
具体操作:装配好仪器并检查装置气密性,接下来的操作依次是:
①往烧瓶中加入足量MnO2粉末
②往烧瓶中加入20mL 12molL-1浓盐酸
③加热使之充分反应。
(1)在实验室中,该发生装置除了可以用于制备Cl2,还可以制备下列哪些气体______?
A. O2 B. H2 C. CH2=CH2 D. HCl
若使用甲方案,产生的 Cl2必须先通过盛有 ________(填试剂名称)的洗气瓶, 再通入足量 AgNO3溶液中,这样做的目的是 ______________;已知AgClO易溶于水,写出Cl2与AgNO3溶液反应的化学方程式________________
(2)进行乙方案实验:准确量取残余清液,稀释5倍后作为试样。准确量取试样25.00mL,用1.500mol·L-1NaOH标准溶液滴定,选用合适的指示剂,消耗NaOH标准溶液23.00mL,则由此计算得到盐酸的临界浓度为 ____ mol·L-1(保留两位有效数字);选用的合适指示剂是 _____。
A 石蕊 B 酚酞 C 甲基橙
(3)判断丙方案的实验结果,测得余酸的临界浓度_________ (填偏大、偏小或―影响)。(已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11)
(4)进行丁方案实验:装置如图二所示(夹持器具已略去)。
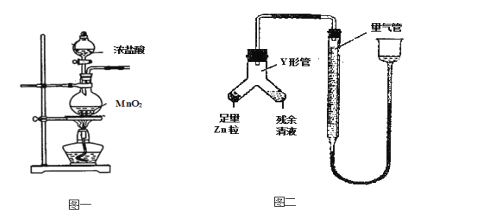
(i)使Y形管中的残余清液与锌粒反应的正确操作是倾斜Y形管,将 _____转移到_____中。
(ii)反应完毕,需要读出量气管中气体的体积,首先要___________,然后再______,最后视线与量气管刻度相平。
(5)综合评价:事实上,反应过程中盐酸浓度减小到临界浓度是由两个方面所致,一是反应消耗盐酸,二是盐酸挥发,以上四种实验方案中,盐酸挥发会对哪种方案带来实验误差(假设每一步实验操作均准确)?____________
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡(Sn)、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
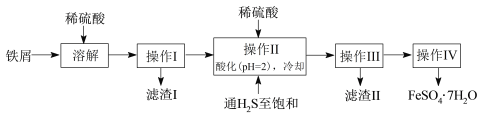
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)溶解时需加热,当看到_____________________________________(填现象)时应停止加热,并趁热进行操作I的原因是______________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_______________________________;在溶液中用硫酸酸化至pH= 2的目的是_________________________________。
(3)操作IV的顺序依次为:____________、____________、______________。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是_________________________________。
②计算上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com