
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡(Sn)、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
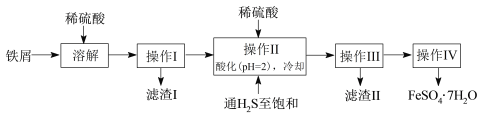
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)溶解时需加热,当看到_____________________________________(填现象)时应停止加热,并趁热进行操作I的原因是______________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_______________________________;在溶液中用硫酸酸化至pH= 2的目的是_________________________________。
(3)操作IV的顺序依次为:____________、____________、______________。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是_________________________________。
②计算上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
【答案】溶液中气泡较少时 防止FeSO4·7H2O结晶析出损耗 除去溶液中的Sn2+离子,并防止Fe2+被氧化 防止Fe2+离子生成沉淀 蒸发 冷却结晶 过滤 降低洗涤过程中FeSO4·7H2O的损耗 滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色 0.975
【解析】
铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓缩、冷却结晶、过滤可得到FeSO47H2O。
(1)铁和锡都可以和稀硫酸反应生成氢气,所以当看到溶液中气泡较少时,说明固体基本反应完全,应停止加热;温度降低FeSO4下降有可能会有FeSO4·7H2O结晶析出,所以要趁热过滤;
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,同时生成SnS沉淀将锡离子除去;已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,在溶液pH=2时,Sn2+完全沉淀,亚铁离子不沉淀;
(3)滤液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤;
冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,同时避免绿矾溶解带来的损失;
(4)①滴定过程中发生反应5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O,滴定终点MnO4不再被还原,溶液呈浅红色,所以滴定终点现象为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
②滴定过程中发生反应5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O,消耗KMnO4溶液体积的平均值为20.00 mL,根据方程式可知25mL待测液中n(Fe2+)=5×0.02L×0.01000 mol/L=0.001mol,则250mL待测中n(Fe2+)=0.01mol,即n(FeSO4·7H2O)=0.01mol,所以质量分数为![]() 。
。


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】电石中的碳化钙和水能完全反应![]() ,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从从上到下,从左到右直接连接的顺序(填各仪器,导管的序号) 接 接 接 接 接 。_________
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次)
①称取一定量电石,置于仪器3中,塞紧橡皮塞
②检查装置的气密性
③在仪器6和5中注入适量水
④待仪器3恢复至室温时,量取仪器4中水的体积(导管2中水的体积忽略不计)
⑤慢慢开启仪器6 的活塞,使水逐滴滴下至不发生气体时,关闭活塞。
正确操作顺序(用操作编号填写)是____________________________
(3)若实验中产生的气体存在难闻的气味,且测定结果偏大,这是因为电石中含有杂质气体,可以用___________________(填试剂)加以除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:有关下列曲线图的说法正确的是( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化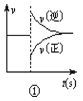
B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的硫酸溶液时pH变化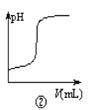
C.曲线图③可以表示向一定量的氯化铝溶液中滴加一定浓度的氢氧化钠溶液时的产生沉淀的物质的量变化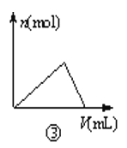
D.曲线图④可以表示所有的固体物质溶解度随温度的变化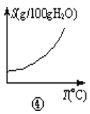
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应。有关叙述正确的是
A. 固体分解越完全,消耗盐酸的量越少
B. 共生成0.1mol二氧化碳,固体中氯化钠为5.85g
C. 固体中碳酸氢钠含量越多,钠元素的含量也越多
D. 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝、硫酸和盐酸, “两碱”指烧碱和纯碱。回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:________
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列_____
(3)氯的非金属性比硫______(填“强”或“弱”),请用两个事实说明你的结论_______
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①_____________________
②Na2CO3;
③_____________________
④NaHCO3。
若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是___g
(5)将Na2CO3溶于水得到下列数据:
水 | Na2CO3 | 混合前温度 | 混合后温度 |
35ml | 3.2g | 20 | 24.3 |
Na2CO3溶于水______(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释_________
(6) Na2CO3溶液显碱性的原因是(写离子方程式) ___________ ,写出该溶液中的电荷守恒表达式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时溶解度:AgCl> AgI,若在5 mL含有KCl和KI各为0.01mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托卡朋(结构简式为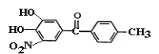 )是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
)是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
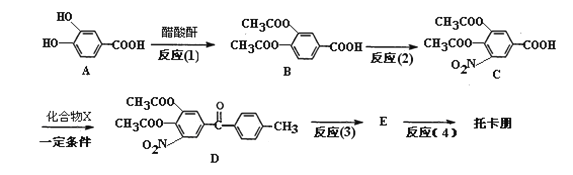
已知醋酸酐为两分子醋酸脱水形成的,结构简式为(CH3CO)2O。
(1)反应(1)的反应类型为____________,反应(2)的试剂和条件为________________。
(2)A分别与浓溴水、碳酸氢钠溶液、氢氧化钠溶液充分反应,所消耗的溴单质、碳酸氢钠、氢氧化钠的物质的量之比为________________。
(3)已知X为苯的相邻同系物,检验苯中含X的试剂为______________________。
(4)反应(1)的目的是__________________________________________________。
(5)D经过两步反应生成托卡朋,反应(3)的化学方程式为________________________。反应(4)中加入____________(试剂名称),得到托卡朋。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案、现象、得出的结论均正确的是( )
选项 | 实验及现象 | 结论 |
A | 用酸度计测定 |
|
B | 向待测液中依次滴入氯水和 | 待测溶液中含有 |
C | 向酸化的 | 证明 |
D | 其他条件相同,测定等浓度的 | td style="width:153.75pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.62pt; vertical-align:middle">
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物聚合物M:![]() 是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:
是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:
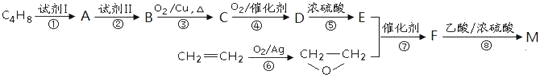
回答下列问题:
(1)C4H8的结构简式为_________________,试剂II是________________。
(2)检验B反应生成了C的方法是___________________________________________。
(3)D在一定条件下能发生缩聚反应生成高分子化合物,反应的化学方程式为___________;
(4)反应步骤③④⑤不可以为⑤③④的主要理由是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com