
【题目】托卡朋(结构简式为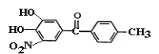 )是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
)是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
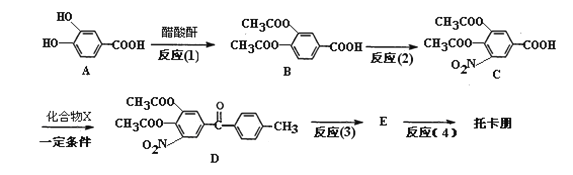
已知醋酸酐为两分子醋酸脱水形成的,结构简式为(CH3CO)2O。
(1)反应(1)的反应类型为____________,反应(2)的试剂和条件为________________。
(2)A分别与浓溴水、碳酸氢钠溶液、氢氧化钠溶液充分反应,所消耗的溴单质、碳酸氢钠、氢氧化钠的物质的量之比为________________。
(3)已知X为苯的相邻同系物,检验苯中含X的试剂为______________________。
(4)反应(1)的目的是__________________________________________________。
(5)D经过两步反应生成托卡朋,反应(3)的化学方程式为________________________。反应(4)中加入____________(试剂名称),得到托卡朋。
【答案】取代 浓硝酸和浓硫酸、加热 3:1:3 酸性KMnO4溶液 保护酚羟基,防止被浓硝酸氧化 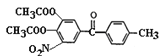 +2NaOH
+2NaOH![]()
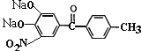 +4CH3COONa + 2H2O 盐酸或稀硫酸
+4CH3COONa + 2H2O 盐酸或稀硫酸
【解析】
A与醋酸酐发生取代生成B,B在浓硫酸和浓硝酸加热的条件发生硝化反应生成C,结合D的结构简式可知X应为甲苯,甲苯取代C中羧基上的羟基生成D,结合托卡朋的结构简式和D的结构简式可知E应为 ,酸化后生成托卡朋。
,酸化后生成托卡朋。
(1)比较A和B的结构可判断反应(1)的反应类型为取代反应,反应(2)为B中苯环上引入硝基的反应,所以反应所需试剂和条件浓硝酸、浓硫酸、加热;
(2)根据A中的官能团可知,A中苯环上酚羟基邻对位上的氢能被溴取代,1molA可以与3molBr2反应,羧基能与碳酸氢钠溶液,1molA可以与1mol碳酸氢钠反应,酚羟基和羧基都能与氢氧化钠溶液反应,1molA可以与3mol氢氧化钠反应,所以消耗的溴单质、碳酸氢钠、氢氧化钠的物质的量之比为3:1:3;
(3)已知X为苯的相邻同系物,则X为甲苯,甲苯可使酸性高锰酸钾溶液褪色,所以可用酸性高锰酸钾溶液检验苯中是否含甲苯;
(4)A中含有酚羟基,托卡朋含有相同的酚羟基,该流程中反应(2)要在浓硫酸、浓硝酸加热的条件下进行,酚羟基可能被氧化,所以反应(1)的目的是保护酚羟基,防止被浓硝酸氧化;
(5)比较D和托卡朋的结构可知,由D经过两步反应生成托卡朋,流程为将D碱性水解再酸化即可得到托卡朋,所以反应(3)的化学方程式为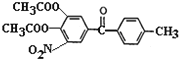 +4NaOH
+4NaOH![]()
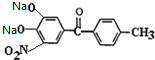 +2CH3COONa+2H2O,反应(4)中加入稀盐酸或稀硫酸进行酸化得到托卡朋。
+2CH3COONa+2H2O,反应(4)中加入稀盐酸或稀硫酸进行酸化得到托卡朋。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
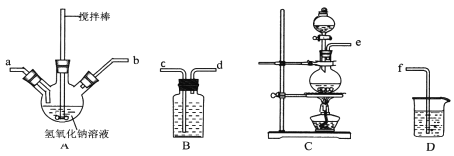
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
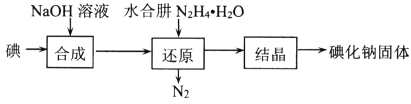
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡(Sn)、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
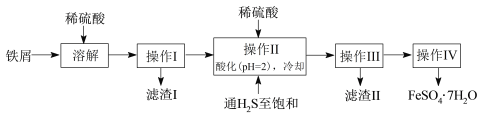
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)溶解时需加热,当看到_____________________________________(填现象)时应停止加热,并趁热进行操作I的原因是______________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_______________________________;在溶液中用硫酸酸化至pH= 2的目的是_________________________________。
(3)操作IV的顺序依次为:____________、____________、______________。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是_________________________________。
②计算上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.1000 mol/L Na2CO3溶液25 mL用0.1000 mol/L盐酸滴定,其滴定曲线如图。
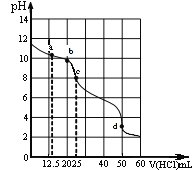
对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
A.a点:c(CO32-)>c(HCO3-)>c(OH-)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
A.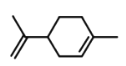 和
和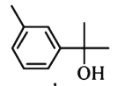 都属于芳香族化合物
都属于芳香族化合物
B. 和
和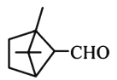 分子中所有碳原子均处于同一平面上
分子中所有碳原子均处于同一平面上
C. 、
、 和
和 均能使酸性
均能使酸性![]() 溶液褪色
溶液褪色
D. 和
和 均能与新制的
均能与新制的![]() 反应生成红色沉淀
反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: I1=738kJ·mol-1 I2=1451kJ·mol-1 I3=7733kJ·mol-1 I4=10540kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:___。
(2)B元素基态原子中能量最高的电子的电子云在空间有___个伸展方向,原子轨道呈___形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为![]() ,该同学所画的电子排布图违背了___。
,该同学所画的电子排布图违背了___。
(4)E位于第__族、__区,该元素原子的核外电子排布式为___。
(5)检验D元素的方法是___,请用原子结构的知识解释产生此现象的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.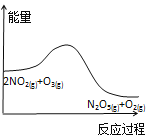 降低温度,平衡向正反应方向移动
降低温度,平衡向正反应方向移动
B. 0-3s内,反应速率v(NO2)=0.2mol·L-1
0-3s内,反应速率v(NO2)=0.2mol·L-1
C.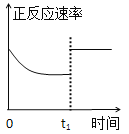 t1时仅加入催化剂,平衡正向移动
t1时仅加入催化剂,平衡正向移动
D.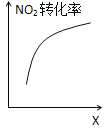 达到平衡时,仅改变X,则X为c(O2)
达到平衡时,仅改变X,则X为c(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com