
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成。下列说法正确的是( )
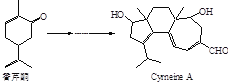
A.香芹酮化学式为C9H12O
B.Cyrneine A可以发生加成反应、消去反应和氧化反应
C.香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D.香芹酮和Cyrneine A可以通过氯化铁溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1 HCN溶液中滴加0.1 mol·L-1NaOH的溶液,由水电离的氢氧根离子浓度随加入NaOH体积的变化如图所示,则下列说法正确的是 ( )
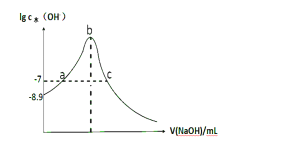
A.常温下,0.1 mol·L-1HCN的电离常数 K a数量级为10-8
B.a、c两点溶液均为中性
C.当 V(NaOH)=10mL时:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D.当V(NaOH)=30mL时:2c(OH-)-2c(H+)=c(CN-)+3c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:有关下列曲线图的说法正确的是( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化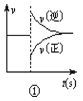
B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的硫酸溶液时pH变化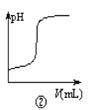
C.曲线图③可以表示向一定量的氯化铝溶液中滴加一定浓度的氢氧化钠溶液时的产生沉淀的物质的量变化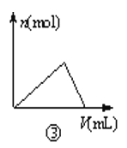
D.曲线图④可以表示所有的固体物质溶解度随温度的变化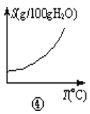
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Q1= 102 kJ·mol-1
3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△Q2= 422 kJ·mol-1
写出在溶液中NaClO分解生成NaClO3的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应。有关叙述正确的是
A. 固体分解越完全,消耗盐酸的量越少
B. 共生成0.1mol二氧化碳,固体中氯化钠为5.85g
C. 固体中碳酸氢钠含量越多,钠元素的含量也越多
D. 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝、硫酸和盐酸, “两碱”指烧碱和纯碱。回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:________
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列_____
(3)氯的非金属性比硫______(填“强”或“弱”),请用两个事实说明你的结论_______
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①_____________________
②Na2CO3;
③_____________________
④NaHCO3。
若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是___g
(5)将Na2CO3溶于水得到下列数据:
水 | Na2CO3 | 混合前温度 | 混合后温度 |
35ml | 3.2g | 20 | 24.3 |
Na2CO3溶于水______(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释_________
(6) Na2CO3溶液显碱性的原因是(写离子方程式) ___________ ,写出该溶液中的电荷守恒表达式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托卡朋(结构简式为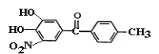 )是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
)是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
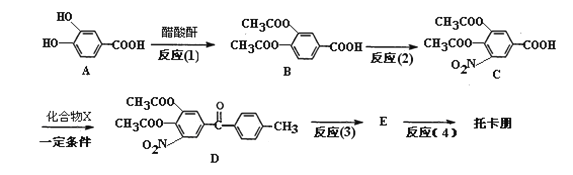
已知醋酸酐为两分子醋酸脱水形成的,结构简式为(CH3CO)2O。
(1)反应(1)的反应类型为____________,反应(2)的试剂和条件为________________。
(2)A分别与浓溴水、碳酸氢钠溶液、氢氧化钠溶液充分反应,所消耗的溴单质、碳酸氢钠、氢氧化钠的物质的量之比为________________。
(3)已知X为苯的相邻同系物,检验苯中含X的试剂为______________________。
(4)反应(1)的目的是__________________________________________________。
(5)D经过两步反应生成托卡朋,反应(3)的化学方程式为________________________。反应(4)中加入____________(试剂名称),得到托卡朋。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图可设计成多种用途的电化学装置。下列分析正确的是
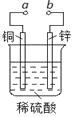
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法
C.当a和b用导线连接时,铜片上发生的反应为:2H++2e-=H2↑
D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com