
【题目】下图可设计成多种用途的电化学装置。下列分析正确的是
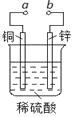
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法
C.当a和b用导线连接时,铜片上发生的反应为:2H++2e-=H2↑
D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
A.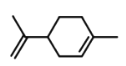 和
和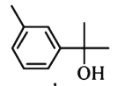 都属于芳香族化合物
都属于芳香族化合物
B. 和
和 分子中所有碳原子均处于同一平面上
分子中所有碳原子均处于同一平面上
C. 、
、 和
和 均能使酸性
均能使酸性![]() 溶液褪色
溶液褪色
D. 和
和 均能与新制的
均能与新制的![]() 反应生成红色沉淀
反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: I1=738kJ·mol-1 I2=1451kJ·mol-1 I3=7733kJ·mol-1 I4=10540kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:___。
(2)B元素基态原子中能量最高的电子的电子云在空间有___个伸展方向,原子轨道呈___形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为![]() ,该同学所画的电子排布图违背了___。
,该同学所画的电子排布图违背了___。
(4)E位于第__族、__区,该元素原子的核外电子排布式为___。
(5)检验D元素的方法是___,请用原子结构的知识解释产生此现象的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为______
(2)B元素的![]() 价离子和C元素的
价离子和C元素的![]() 价离子的核外电子排布情况均与氩原子相同,则B元素的
价离子的核外电子排布情况均与氩原子相同,则B元素的![]() 价离子的结构示意图为______,C元素原子有______个能层,______个能级,______个非空原子轨道
价离子的结构示意图为______,C元素原子有______个能层,______个能级,______个非空原子轨道
(3)D元素的![]() 价离子的3d能级为半充满状态,D的元素符号为______,其基态原子的核外电子排布式为______
价离子的3d能级为半充满状态,D的元素符号为______,其基态原子的核外电子排布式为______
(4)E元素基态原子的M层全充满,N层只有一个电子,E的元素符号为______,其基态原子的简化电子排布式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.对于2HI(g)![]() H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
B.合成氨反应中为提高氨的产率,理论上应采取降低温度的措施
C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释
D.用饱和食盐水可以去除Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.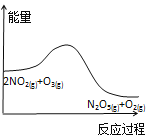 降低温度,平衡向正反应方向移动
降低温度,平衡向正反应方向移动
B. 0-3s内,反应速率v(NO2)=0.2mol·L-1
0-3s内,反应速率v(NO2)=0.2mol·L-1
C.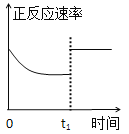 t1时仅加入催化剂,平衡正向移动
t1时仅加入催化剂,平衡正向移动
D.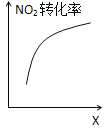 达到平衡时,仅改变X,则X为c(O2)
达到平衡时,仅改变X,则X为c(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A分子的立体结构图(其中C、H原子已去):因其分子中碳原子排列类似金刚石故名“金刚烷”,下列错误的是()
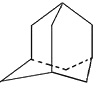
A. 金刚烷分子式是C10H16
B. 金刚烷分子的二氯代物有4种
C. 金刚烷分子中有4个六元环组成
D. 金刚烷分子的一氯代物有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com