
【题目】烃A分子的立体结构图(其中C、H原子已去):因其分子中碳原子排列类似金刚石故名“金刚烷”,下列错误的是()
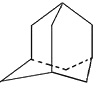
A. 金刚烷分子式是C10H16
B. 金刚烷分子的二氯代物有4种
C. 金刚烷分子中有4个六元环组成
D. 金刚烷分子的一氯代物有2种
【答案】B
【解析】
由结构简式可知金刚烷中每个C原子与其它C原子形成单键,金刚烷的分子式为C10H16,分子中含有4个六元环,分子中有2种等效氢原子,以此解答。
A.由结构可知,含4个CH,6个CH2,则分子式为C10H16,选项A正确;
B.金刚烷中氢有两种:-CH-、-CH2-,故二氯取代,可以固定一氯,移动另一氯,①固定-CH-,故另一氯可位于六元环的邻、间、对三种,②固定-CH2-,另一可位于同环的1号、3号碳位和异环的-CH2-位,三种,共6种,选项B错误;
C.由金刚烷的键线式,可知分子内由C原子构成的最小的环上有6个C原子,这种环有4个,选项C正确;
D.含4个CH,6个CH2,含2种位置的H,则一氯代物有2种,选项D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:
(1)![]()
![]()
(2)![]()
![]()
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。
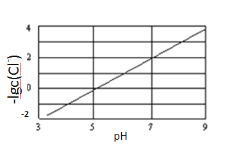
下列说法正确的是( )
A. 溶液pH越大,Ksp(CuCl)增大
B. 反应达到平衡时增大c(Cu2+),c(Cl-)减小
C. 该过程中,Cu+起到了催化剂的作用
D. 从反应自发性角度分析,如反应(2)能自发进行,则b>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
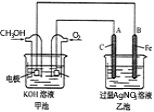
(1)甲电池是_________装置,乙池是_________装置。
(2)通入CH3OH的电极名称是_______,A(石墨)电极的名称是________。
(3)通入O2的电极的电极反应式是________________________。B(Fe)电极的电极反应式为___________________________。
(4)乙池中反应的化学方程式为___________________________。
(5)当乙池中B(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_____mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体
是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体![]() 流程如下:
流程如下:

下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入![]() 氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调
氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调![]() ,则溶液中
,则溶液中![]() _______________。(已知
_______________。(已知![]() ,
,![]() )
)
(2)滤液A的溶质主要是______________________。
(3)操作①的实验方法依次是_____________、_____________、过滤、洗涤、干燥,操作②的实验方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1molL-1的A、B溶液各10mL ④0.5molL-1的A、B溶液各50mL
四者反应速率的大小关系是
A. ②>①>④>③ B. ④>③>②>①
C. ①>②>④>③ D. ①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】335℃时,在恒容密闭反应器中1.00mol![]() 催化脱氢的反应过程如下:
催化脱氢的反应过程如下:
反应1:![]()
反应2:![]()
测得![]() 和
和![]() 的产率
的产率![]() 和
和![]() (以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
(以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
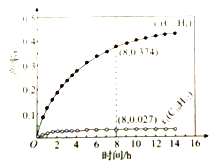
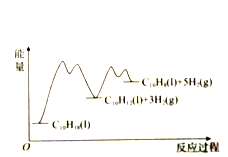
A. 使用催化剂能改变反应历程
B. 更换催化剂后![]() 、
、![]() 也会随之改变
也会随之改变
C. 8h时,反应1、2都未处于平衡状态
D. ![]() 显著低于
显著低于![]() ,是由于反应2的活化能比反应1的小,反应1生成的
,是由于反应2的活化能比反应1的小,反应1生成的![]() 很快转变成
很快转变成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大B,平衡向右移动B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是动物必需的营养元素和植物有益的营养元素,可以形成SeO2、H2SeO3、H2SeO4等化合物。
(1)硒的原子结构示意图可表示为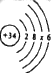 ,则x的值为_____。
,则x的值为_____。
(2)向亚硒酸溶液中通入二氧化硫,有单质硒析出,写出该反应的化学方程式: _______。
(3)已知:Se(s)+H2(g)+2O2(g)=H2SeO4(s) ΔH1;
H2(g)+![]() O2(g)=H2O(l) ΔH2;
O2(g)=H2O(l) ΔH2;
2SeO2(g)+O2(g)+2H2O(l)=2H2SeO4(s) ΔH3。
则反应Se(s)+O2(g)=SeO2(g)的ΔH=____。(用含ΔH1、ΔH2、ΔH3的代数式表示)
(4)温度为T℃时,向2.0L恒容密闭容器中充入1.0molH2SeO3(g),发生反应:H2SeO3(g)![]() SeO2(g)+H2O(g) △H=+a kJ/mol。0~10min保持容器中温度不变,10min时改变一种条件,整个过程中H2SeO3(g)、SeO2(g)、H2O(g)的物质的量随时间的变化如图所示:
SeO2(g)+H2O(g) △H=+a kJ/mol。0~10min保持容器中温度不变,10min时改变一种条件,整个过程中H2SeO3(g)、SeO2(g)、H2O(g)的物质的量随时间的变化如图所示:
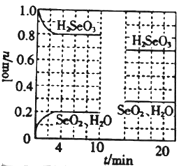
①要提高平衡时SeO2的体积分数,可采取的措施有______(填字母)。
a.容器体积不变,升高反应温度
b.使用高效催化剂
c.温度和容积不变,减小H2SeO3的起始量
d.温度不变,压缩容器体积,增大压强
②0~4min的平均反应速率v(H2O)=______;
③10min时改变的条件是_____;
④温度为T℃时,该反应的平衡常数K为______。若起始时向该容器中充入2.0mol H2SeO3(g)、1.0 mol SeO2(g)和0.15 mol H2O(g),反应达到平衡前,v(正)____(填“大于”“小于”或“等于”)v(逆)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com