
| A、浓盐酸和铁屑反应:2Fe+6H+═2Fe3++3H2 ↑ |
| B、碳酸钙与醋酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用澄清的石灰水吸收过量的CO2:CO2+OH-═HCO3- |
| D、向NaHSO4溶液中加入Ba(OH)2 使SO42-恰好完全沉淀:Ba2++2OH-+2H++SO42-═BaSO4 ↓+2H2O |


科目:高中化学 来源: 题型:
 在恒容密闭容器中进行的反应:2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g)△H.在某压强下起始时按不同氢碳[
在恒容密闭容器中进行的反应:2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g)△H.在某压强下起始时按不同氢碳[| n(H2) |
| n(CO2) |
| A、该反应:△H>0 |
| B、氢碳比:①<②<③ |
| C、其它条件不变的情况下,缩小容器的体积CO2的转化率降低 |
| D、若起始CO2浓度为2mol?L-1、H2为4mol?L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最外层电子数是次外层电子数的2倍 |
| Y | Y的单质为黄色晶体,是制黑火药的原料之一 |
| Z | Z和Y同周期,原子半径:Y>Z |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
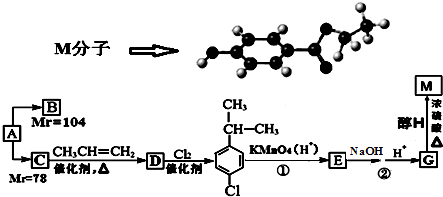
查看答案和解析>>
科目:高中化学 来源: 题型:
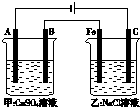 如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| PdCl2 |

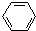 +CH2=CH2
+CH2=CH2| AlCl3 |
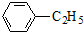 G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下:
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下: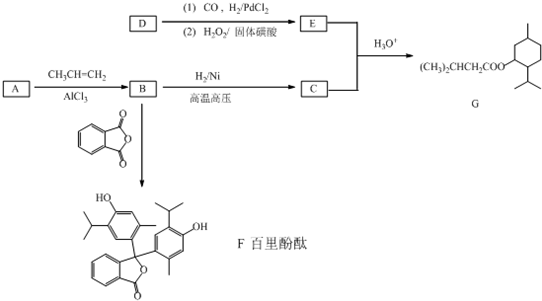
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com