
【题目】X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Z原子的K层与M层电子数和等于其L层电子数,下列说法不正确的是
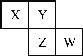
A. Y的气态简单氢化物比X的稳定
B. 含W元素的酸一定比含Z元素的酸的酸性强
C. Y的非金属性比Z的强
D. X与Y形成的化合物有的能与水反应
【答案】B
【解析】
X、Y、Z均为短周期元素,Z原子的K层与M层电子数和等于其L层电子数,即2+6=8,故Z为S元素,则W为Cl,Y为O, X为N。据此解答。
根据上述分析,X为N元素,Y为O元素,Z为S元素, W为Cl元素。A.同周期元素从左到右元素的非金属性逐渐增大,Y的气态氢化物的稳定性比X的强,故A正确;B.非金属性Cl>S,所以最高价氧化物对应水化物的酸性W比Z强,但含W元素的酸不一定是最高价氧化物对应水化物,如次氯酸为弱酸,酸性小于硫酸,故B错误;C.同主族从上到下非金属性逐渐减弱,则非金属性O>S,故C正确;D.X与Y形成的化合物可以是一氧化氮或二氧化氮等,二氧化氮能与水反应,故D正确;故选B。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年报道了使用α-溴代羰基化合物合成大位阻醚和硫醚的有效方法,可用于药物化学和化学生物学领域。用此法合成化合物J的路线如下:

已知:
回答下列问题:
(1)A的结构简式为____________。D中含有的官能团名称是____________。
(2)由B生成C的化学方程式是______________________。
(3)C→D所需试剂和反应条件为_____________________。
(4)G的化学名称为_____________,F+H→J的反应类型是___________。
(5)F与C在CuBr和磷配体催化作用下也可合成大位阻醚,写出一种有机产物的结构简式:_____________。
(6)化合物X是E的同分异构体,分子中不含羧基,既能发生水解反应,又能与金属钠反应。符合上述条件的X的同分异构体有_____种(不考虑立体异构),其中能发生银镜反应,核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )
A.Na2CO3和Na2O2B.只有Na2CO3
C.Na2CO3和NaOHD.Na2O和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性KMnO4溶液褪色,且有气泡产生。将酸性KMnO4溶液换成FeCl3溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是( )

A. 20℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3溶液时,产生的气体为Cl2
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的刚性密闭容器中,加入1mol CO2和3mol H2,发生反应CO2+3H2CH3OH+H2O.在其他条件不变的情况下,温度对反应的影响结果如图所示(注:T1、T2均大于300℃)。下列说法正确的是

A. 该反应在T1时的平衡常数比T2时的小
B. 处于A点的反应体系从T1变到T2,达到平衡时![]() 减小
减小
C. T2下,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=![]() molL﹣1min﹣1
molL﹣1min﹣1
D. T1下,若反应达到平衡后CO2转化率为a,则容器内的压强与起始压强之比为(2﹣a):2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是
A. 是氢元素的一种新的同素异形体
B. 是氢元素的一种新的同位素
C. 该微粒的组成可用H3表示
D. 该微粒比普通氢分子多一个氢原子核
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图,下列判断中正确的是

A. 电路中电子的流动方向:adCuSO4(aq) cb
B. 该原电池原理:Zn+CuSO4 ═ ZnSO4+Cu
C. c电极质量减少量等于d电极质量增加量
D. d电极反应:Cu2++2e = Cu,反应后CuSO4溶液浓度下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com