
����Ŀ��2018�걨����ʹ����-����ʻ�������ϳɴ�λ���Ѻ����ѵ���Ч������������ҩ�ﻯѧ�ͻ�ѧ����ѧ�����ô˷��ϳɻ�����J��·�����£�

��֪��
�ش��������⣺
(1)A�Ľṹ��ʽΪ____________��D�к��еĹ�����������____________��
(2)��B����C�Ļ�ѧ����ʽ��______________________��
(3)C��D�����Լ��ͷ�Ӧ����Ϊ_____________________��
(4)G�Ļ�ѧ����Ϊ_____________��F��H��J�ķ�Ӧ������___________��
(5)F��C��CuBr���������������Ҳ�ɺϳɴ�λ���ѣ�д��һ���л�����Ľṹ��ʽ��_____________��
(6)������X��E��ͬ���칹�壬�����в����Ȼ������ܷ���ˮ�ⷴӦ������������Ʒ�Ӧ����������������X��ͬ���칹����_____�֣������������칹���������ܷ���������Ӧ���˴Ź���������3��壬�����֮��Ϊ1:1:6�Ľṹ��ʽΪ_____________��
���𰸡� �ǻ���ȩ��
�ǻ���ȩ�� 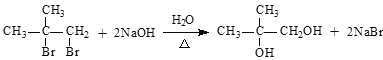 O2��Cu��Ag������������ ���� ȡ����Ӧ
O2��Cu��Ag������������ ���� ȡ����Ӧ 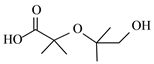 ��
�� ��
�� 11
11 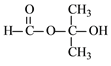
��������
�ɺϳ����̿�֪��A��C��̼���Ǽ���ͬ��A�����ӳɷ�Ӧ����B��Bˮ������C����AΪCH2=C(CH3)2��A����ӳ�����BΪCH2BrCBr(CH3)2��C��������DΪOHCC(OH)(CH3)2��D��������EΪ(CH3)2C(OH)COOH��E����OH����ȡ����Ӧ����F�����J�Ľṹ��֪HΪ![]() ��GΪ���ӣ��ݴ˽��
��GΪ���ӣ��ݴ˽��
(1)A�Ľṹ��ʽΪCH2=C(CH3)2��D�й���������Ϊ�ǻ���ȩ����
(2)��B����C�Ļ�ѧ����ʽ�� ��
��
(3)C��D�����Լ�O2����Ӧ����ΪCu��Ag��������������
(4)G�Ļ�ѧ����Ϊ���ӣ�F+H��J�ķ�Ӧ������ȡ����Ӧ������-OH��H��ȡ����
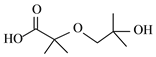
(5)F��C��CuBr���������������Ҳ�ɺϳɴ�λ���ѣ��л�����Ľṹ��ʽΪ ��
�� ��
�� ��
��
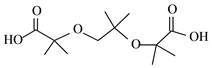
(6)EΪ(CH3)2C(OH)COOH��������X��E��ͬ���칹�壬�����в����Ȼ������ܷ���ˮ�ⷴӦ������������Ʒ�Ӧ������������COO�����ǻ���OH����Ϊ�����������OH��3��λ�ã���Ϊ�������������OH��2��λ�ã���Ϊ������������OH��3��λ�ã���Ϊ�����������OH��3��λ�ã����Թ�11�ֲ�ͬ�ṹ�������ܷ���������Ӧ���˴Ź���������3��壬�����֮��Ϊ1��1��6�Ľṹ��ʽΪ ��
��


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������ͼ��ʾװ��̽�������������ķ�Ӧ���������⣬�ش��������⣺

(1)CH4��Cl2������Ӧ��������________�������չ�ֱ�䣬���ܻ�����_____________��
(2)ʵ���пɹ۲��ʵ�������У���Ͳ�ڱڳ�����״Һ�Σ�����ʳ��ˮ������������������________________��__________________�ȡ�
(3)ʵ�������ɵ���״Һ���е��ȷ¿����ֲ������������治���������������������綾���壭��������Ӧ�Ļ�ѧ����ʽΪ2CHCl3��O2��2COCl2��2HCl��������Ӧ_______(��ѡ����ţ���ͬ)��
������ȡ����Ӧ�� �ڲ�����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������˵����ȷ����_________
a����0.1mol/L 100mL CH3COONa����Һ���ټ�0.1mol CH3COONa��s����CH3COO��/Na+ ���
b����0.1mol/L�Ķ�Ԫ������Na2A�в���ͨ��HCl(g)��,��c(H+)/c(H2A)�ȱ����С
c����֪��FeCl3��aq��+ 3KSCN��aq��![]() 3KCl��aq��+Fe��SCN��3��aq�������ƽ����ϵ�м������KCl����Һ��ɫ��dz
3KCl��aq��+Fe��SCN��3��aq�������ƽ����ϵ�м������KCl����Һ��ɫ��dz
d������ʱ��0.1mol/L NH4HCO3��ҺPH=8.1����Ka1(H2CO3) ��Kb(NH3��H2O)��Ka2(H2CO3)
��2��̼����������������ԭ������ԭ��Ϊ��
MoOS2��s��+4H2��g��+2Na2CO3��s��MoO��s��+2CO��g��+4H2O��g��+2Na2S��s����H.ʵ����ƽ��ʱ���йر仯������ͼ��ʾ��

ͼ1���¶���ƽ��ʱ����ɷֵĹ�ϵͼ2�������淴Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ
��һ���¶��£������Ϊ�̶����ܱ������н���������Ӧ��������˵����Ӧ�ﵽ��ƽ��״̬����__������ţ���
A��2v��(H2)=v��(CO) B��CO����������ֲ���
C����������ƽ����Է����������ٱ仯 D.��H���ٱ仯
��ͼ1��A���Ӧ��ƽ�ⳣ��Kp= _________________����֪A��ѹǿΪ0. lMPa����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
���ۺ����������õ���ͼ2�У����б�ʾ�淴Ӧ��ƽ�ⳣ��(K��)��������________(�A����B��)��T1��Ӧ��ƽ�ⳣ��Ϊ__________��
��3��ˮ����(N2H4��H2O)��������¯ˮ�ij�������N2H4��H2OΪ��Ԫ�����ˮ��Һ�е�һ�����뷽��ʽ��ʾΪN2H4��H2O![]() N2H5++OH����������(N2H6Cl2)��һ�ֿ������Σ����һ��ˮ������ӷ���ʽΪ_____________________,��Һ������Ũ���ɴ�С������˳��Ϊ______________��
N2H5++OH����������(N2H6Cl2)��һ�ֿ������Σ����һ��ˮ������ӷ���ʽΪ_____________________,��Һ������Ũ���ɴ�С������˳��Ϊ______________��
��4������һ����Ҫ�ĵ��ʡ���ҵ�ϳɰ���ӦΪ��1/2 N2(g)+ 3/2 H2(g)![]() NH3(g),�÷�Ӧ�Ļ��Ea1=254kJ/mol����������,��ػ�ѧ�������������£�
NH3(g),�÷�Ӧ�Ļ��Ea1=254kJ/mol����������,��ػ�ѧ�������������£�
��ѧ�� | H-H | N | N-H |
E/kJ��mol-1 | 436 | 946 | 391 |
��ӦNH3(g)![]() 1/2N2(g)+3/2H2(g)�Ļ��Ea2=________________
1/2N2(g)+3/2H2(g)�Ļ��Ea2=________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.����������ȼ�գ�����ʻ�ɫ��������ɫ����
B.������������ȼ�գ�������ɫ����
C.���ȵ�ͭ˿�����������ȼ�գ�������ɫ����
D.��Ͷ��ˮ�У�����ˮ�����ۻ���С���Ҳ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�������SO2��ת��������Ҫ���塣
��1�������������������ӽ���Ĥȼ�ϵ�������ÿ���������������SO2ת��ΪSO42������װ����ͼ��ʾ��

��װ�������ӣ�H�������ƶ�����Ϊ___________��������A��B��������B��A������
�������ĵ缫��ӦʽΪ___________��
��2���ѳ�ȼú������SO2��һ�ֹ�ҵ�������£�

���ô�����Һ����SO2����ת��ΪHSO3������Ӧ�����ӷ���ʽ��___________��
���������мӹ�����ʯ����ʵ�����������ֲ�����Ż����ճ�����SO2����������SO2�IJ�����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
����25�桢101kPa�£�1g�״�ȼ������CO2��Һ̬ˮʱ����22.68kJ�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ��___________________________________________��
����������N2��O2��ȫ��Ӧ��ÿ����23g NO2��Ҫ����16.95kJ����__________________��
����֪��1mol H��H����1molN��H����1molN��N���ֱ���Ҫ��������436 kJ��391 kJ��946 kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ��________________________________��
��2��������һ�������Դ���ü�����ȡ������������Ӧ�������仯����ͼ��ʾ��

�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��____________��
����II��Ϊ���淴Ӧ����800��ʱ����CO����ʼŨ��Ϊ2.0 mol/L��ˮ��������ʼŨ��Ϊ3.0 mol/L���ﵽ��ѧƽ��״̬���CO2��Ũ��Ϊ1.2 mol/L����˷�Ӧ��ƽ�ⳣ��Ϊ____��CO��ƽ��ת����Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���a mol N2��b mol H2�Ļ������ͨ��һ���̶��ݻ����ܱ������У�������Ӧ��N2(g)+3H2(g) ![]() 2NH3(g)��
2NH3(g)��
��1������Ӧ���е�ijʱ��tʱ��n(N2)=13mol��n(NH3)=6mol��a= ____________��
��2����Ӧ�ﵽƽ��ʱ�������������Ϊ716.8L(��״����)������NH3�ĺ���(�������)Ϊ25%��ƽ��ʱNH3�����ʵ���Ϊ____________��
��3��ԭ���������ƽ��ʱ�������������ʵ���֮��Ϊ ____________����д����������ȣ���ͬ��
��4��ԭ���������a��b= ____________��
��5���ﵽƽ��ʱ��N2��H2��ת����֮��Ϊ ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2 L�Ķ����ܱ������л�ϣ�����һ�������·������·�Ӧ��2A(g)��B(g)![]() 2C(g)����2 s����C�����ʵ���Ũ��Ϊ0.6 mol��L��1���������м���˵����
2C(g)����2 s����C�����ʵ���Ũ��Ϊ0.6 mol��L��1���������м���˵����
��������A��ʾ�����ʱ���ƽ������Ϊ0.3 mol��L��1��s��1
��������B��ʾ�����ʱ���ƽ������Ϊ0.6 mol��L��1��s��1
��2 sʱ����A��ת����Ϊ30%
��2 sʱ����B�����ʵ���Ũ��Ϊ0.3 mol��L��1
������ȷ����
A. �٢� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�������ʻ������֮����ת����ϵ��ͼ��ʾ��AΪ�ؿ��к������������ķǽ���Ԫ�صĵ��ʣ��侧��ṹ����ʯ���ơ�

��ش�
��1���γɵ���A��ԭ�ӵĽṹʾ��ͼΪ________��
��2��E�Ļ�ѧʽΪ________��
��3��B���������Ʒ�Ӧ����D��H2O�Ļ�ѧ����ʽ��________��
��4����D����Һ��ͨ�����CO2��������ӷ���ʽ________��
��5������˵����ȷ����______
A ˮ�ࡢ������ʯӢ�����ȶ��Ǵ�ͳ�����β��ϡ�B �ߴ��ȵĹ赥�ʹ㷺�����������ά��
C ��ѧ�����г��õ��ķ���ɸ�ǹ����β��ϡ�D �����ռ��ѡ���մ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com