
����Ŀ����̬����̬��ֱ���������Ӧ���Ȼ�ѧ����ʽ����:
�� H2(g) +I2(?)![]() 2HI(g) ��Hl=-9.48kJ/mol
2HI(g) ��Hl=-9.48kJ/mol
��H2(g) +I2(?)![]() 2HI(g) ��H2=+26.48kJ/mol
2HI(g) ��H2=+26.48kJ/mol
�����жϲ���ȷ����
A. ���е�I2Ϊ��̬,���е�I2Ϊ��̬
B. �ڵķ�Ӧ���������Ȣٵķ�Ӧ����������
C. ��Ӧ�ٵIJ���ȷ�Ӧ�ڵIJ������ȶ��Ը���
D. lmol��̬������ʱ������35.96kJ
���𰸡�C
��������A�����ݷ�Ӧ���� H=������������������Ӧ�����������˵�����з�Ӧ������������ڢ��з�Ӧ�����������������������̬ʱ�����������ڹ���ʱ������������е�I2Ϊ��̬,���е�I2Ϊ��̬����A��B����ȷ��C������������Ӧ�IJ�����ͬ��״̬��ͬ�����ȶ���Ҳ��ͬ����C����D�����ݸ�˹���ɣ��ڡ��ټ���I2(s)![]() I2(g) �� H=�� H2��Hl =+26.48kJ/mol ��(-9.48kJ/mol)=+35.96 kJ/mol��˵��lmol��̬������Ϊ�������Ҫ����35.96kJ����������D��ȷ���ʱ�����ȷ��ΪC��
I2(g) �� H=�� H2��Hl =+26.48kJ/mol ��(-9.48kJ/mol)=+35.96 kJ/mol��˵��lmol��̬������Ϊ�������Ҫ����35.96kJ����������D��ȷ���ʱ�����ȷ��ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
���仯������������������Ҫ����ɲ��֣�������һЩ�������Ļ�����:
(1)����ͬ���塢����һ�����ڵ�Ԫ�ػ�̬ԭ�ӵļ۲�����Ų�Ϊ___________.
(2)����ͬ�������ڵ�����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__________��(��Ԫ�ط��ű�ʾ)��
(3)������(H3PO3)��һ�ֳ��������ᣬ���������NaOH��Һ��Ӧ����Na2HPO3,�뻭��������ķ��ӽṹ_______�������������ԭ����Cu2+��ԭΪ���ʣ��õ��ĵ�����䵽________�����
(4)��֪PBr5�����д���PBr4+����Br-�������ӣ���PBr4+������Pԭ���ӻ�����Ϊ___�������ӵļ��ι���Ϊ______����PCl5�����д���PCl4+����һ�������ӣ�����������λ��Ϊ6����д�������ӵĻ�ѧʽ:______��PBr5�����в����γ���PCl5����һ���������ӵ�ԭ�������:_________��
(5)���Ͱ�����һ�������¿����Ʊ�����(AlP)�����������Ľṹ��ͼ�����Խ��俴��Si����ġ�����ȵ����塱�������뵼�����.
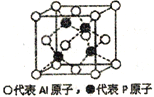
�ٸ��ݡ�����ȵ���ԭ���������������У������ǰ뵼�����____________.
A. SiC B.CaO2 C. GaAs D.Si3N4 E.BN
�������У�Alԭ�ӵ���λ��Ϊ_______�����þ����ܶ�Ϊdg/cm3����NA��ʾ����٤����������þ���ı߳�Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ�����������
A. 2 molˮ��Ħ��������1 molˮ��Ħ������
B. 200 mL 1 mol��L��1�Ȼ�����Һ��c(Cl��)��100 mL 2 mol��L��1�Ȼ�����Һ��c(Cl��)
C. ��״���£�22.4 Lһ����̼����ԭ������16 g������������ԭ����
D. 2 mol��L��1H2SO4��Һ�е�H��������1 mol��L��1HCl��Һ�е�H������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������A�����ϣ��������к�̼Ϊ72.0%������Ϊ6.67%������Ϊ�����������з����ⶨ���л����������Է��������ͷ��ӽṹ��
����һ��������������֪A����Է�������Ϊ150��
���������˴Ź����Dz��A�ĺ˴Ź���������5���壬�����֮��Ϊ1:2:2:2:3������ͼ��ʾ��
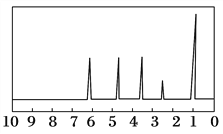
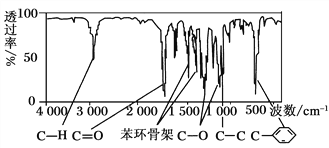
�����������ú�������Dz��A���ӵĺ����������ͼ��ʾ��
����գ�
��1��A�ķ���ʽΪ________��
��2��A�ķ����к�һ������������________��
a��A����Է������� b��A�ķ���ʽ
c��A�ĺ˴Ź�������ͼ d��A���ӵĺ������ͼ
��3��A�Ľṹ��ʽΪ________��
��4��A�ķ�����ͬ���칹���ж��֣����з��������������ٷ��ӽṹ��ֻ��һ�������ţ��ڷ��ӽṹ�к���һ�������۱�����ֻ��һ��ȡ�����������A��ͬ���칹�干��________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,��2L���ܱ������з�����Ӧ:xA(g) +B(g)![]() 2C(g) ��H<0��A�� C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ�������й�˵����ȷ����
2C(g) ��H<0��A�� C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ�������й�˵����ȷ����

A. x=1
B. ��Ӧ���е�1minʱ,��Ӧ��ϵ�ﵽ��ѧƽ��״̬
C. 2min��,A������Ӧ����һ������C���淴Ӧ����
D. 2min��,������A��B�����ʵ���֮��һ��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��������ϵ�֪��ҵ�ϳ��������������� H2O2,��ԭ����������ͼ��ʾ:
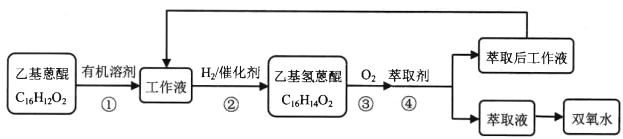
����˵������ȷ����
A. �������Ʊ� H2O2���������ĵ�ԭ����H2��O2,�һ�������ѭ��ʹ��
B. �����Ϊ��ԭ��Ӧ,�����Ϊ������Ӧ
C. ������п�ѡ�� CCl4��Ϊ��ȡ��
D. Ӧ������ȡ����Һ������H2O2,�����ͷŵ���������������ױ�ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��V LŨ��Ϊ1.000 mol��L��1�����ᣬ��ʹ��Ũ������1������ȡ�Ĵ�ʩ��������
A. ��ԭ��Һ��ͨ�볣�³�ѹ�µ�HCl����22.4V L��ʹ����ȫ�ܽ�
B. ����Һ����Ũ����0.5V L
C. ��ԭ��Һ�м���10.00 mol��L��1������0.2V L����ϡ����1.5V L
D. ��ԭ��Һ�м���V L 3 mol��L��1�������Ͼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���ѧʽ������FeSO4xH2O��ʾ���ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش���������:
(1)���Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣�ɴ˿�֪:______��____________��
(2)Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ������(�����˿���K1��K2)(��Ϊװ��A)���أ���Ϊmg������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊng������ͼ���Ӻ�װ�ý���ʵ�顣
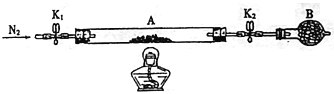
�ٽ�����ʵ�����������ȷ����_______(����)���ظ������������裬ֱ��A���أ���ΪPg��
a.����A b.�ر�K1��K2 c.��ȼ�ƾ��ƣ����� d.��ȴ������
e.��K1��K2������ͨ��N2 f.Ϩ��ƾ���
�ڸ���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀ=__________(��ʽ��ʾ)����ʵ��ʱ��c��e�����������ʹx_____(�ƫ��ƫС������Ӱ�족)��
(3)�������и������������̷�����������ȴ���Ƶ�һ����ɫճ����Һ�塰�̷��͡���������ʣ��Ĺ���Ϊ����ɫ���̷��������ʵĻ�ѧʽΪ______________��
(4)����ͼװ��ģ��(3)�������з�Ӧ�������������̷�һ��ʱ�����D��U�ܳ�����ɫճ����Һ�壬b��Ʒ����Һ��ɫ��

��֪:����������۵�Ϊ16.8�棬�е�Ϊ44.8��
��A���ṩ��Դ����������:______,����װ����ȷ������˳��A��___________ (�ô�д��ĸ��ʾ)��
��д�������̷��Ļ�ѧ����ʽ_____________��
��ʵ������в��˼�������̷�����Ҫԭ����_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com