
【题目】
磷及其化合物是生活生产中重要的组成部分,以下是一些常见的磷的化合物:
(1)与磷同主族、比磷多一个周期的元素基态原子的价层电子排布为___________.
(2)磷与同周期相邻的两种元素的第一电离能由大到小的顺序为__________。(用元素符号表示)。
(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,请画出亚磷酸的分子结构_______。亚磷酸可作还原剂将Cu2+还原为单质,得到的电子填充到________轨道。
(4)己知PBr5晶体中存在PBr4+,和Br-两种离子,则PBr4+,中心P原子杂化类型为___,该离子的几何构型为______。而PCl5晶体中存在PCl4+和另一种阴离子,该阴离子配位数为6,请写出该离子的化学式:______。PBr5晶体中不能形成与PCl5晶体一样的阴离子的原因可能是:_________。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图,可以将其看做Si晶体的“广义等电子体”,可做半导体材料.
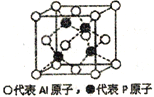
①根据“广义等电子原理”,下列物质中,可能是半导体的有____________.
A. SiC B.CaO2 C. GaAs D.Si3N4 E.BN
②磷化铝中,Al原子的配位数为_______,若该晶胞密度为dg/cm3,用NA表示阿伏伽德罗常数,则该晶体的边长为_______。
【答案】 4s24p3 P>S>Si 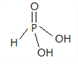 3d、4s sp3杂化 正四面体形 PCl6- Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定 ACE 4
3d、4s sp3杂化 正四面体形 PCl6- Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定 ACE 4 ![]()
【解析】试题分析:(1)与磷同主族、比磷多一个周期的元素是33号元素As;(2)同周期元素从左到右第一电离能逐渐增大,ⅤA族元素P轨道半充满,为稳定结构,第一电离能大于同周期ⅥA族元素;(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,所以H3PO3是二元酸;Cu2+的电子排布式是1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1;(4)PBr4+中P原子的价电子对数是![]() ;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定;(5) ①AlP价电子数为8;②根据晶胞示意图分析Al原子的配位数;②根据
;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定;(5) ①AlP价电子数为8;②根据晶胞示意图分析Al原子的配位数;②根据![]() 计算晶胞边长。
计算晶胞边长。
解析:(1)与磷同主族、比磷多一个周期的元素是33号元素As,最外层有5个电子,基态原子的价层电子排布为4s24p3;(2)同周期元素从左到右第一电离能逐渐增大,ⅤA族元素P轨道半充满,为稳定结构,第一电离能大于同周期ⅥA族元素,所以磷与同周期相邻的两种元素的第一电离能由大到小的顺序为P>S>Si;(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,所以H3PO3是二元酸,含有2个羟基,H3PO3的结构式是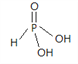 ;Cu2+的电子排布式是1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1,所以得到的电子填充到3d、4s轨道;(4)PBr4+中P原子的价电子对数是
;Cu2+的电子排布式是1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1,所以得到的电子填充到3d、4s轨道;(4)PBr4+中P原子的价电子对数是![]() ,所以P原子杂化类型为sp3;没有孤对电子,所以该离子的几何构型为正四面体形;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1,该离子的化学式PCl6-;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定,所以PBr5晶体中不能形成与PCl5晶体一样的阴离子;(5) ①AlP价电子数为8;A. SiC价电子数为8; B.CaO2价电子数为14; C.GaAs价电子数为8; D.Si3N4价电子数为32; E.BN价电子数为8,所以可能是半导体的有ACE;②根据晶胞示意图,Al原子的配位数4;②根据均摊原则,每个晶胞含有Al原子数
,所以P原子杂化类型为sp3;没有孤对电子,所以该离子的几何构型为正四面体形;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1,该离子的化学式PCl6-;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定,所以PBr5晶体中不能形成与PCl5晶体一样的阴离子;(5) ①AlP价电子数为8;A. SiC价电子数为8; B.CaO2价电子数为14; C.GaAs价电子数为8; D.Si3N4价电子数为32; E.BN价电子数为8,所以可能是半导体的有ACE;②根据晶胞示意图,Al原子的配位数4;②根据均摊原则,每个晶胞含有Al原子数![]() ,每个晶胞含有P原子数4,所以晶胞的摩尔质量是232g/mol,设晶胞边长是a cm,则晶胞体积为
,每个晶胞含有P原子数4,所以晶胞的摩尔质量是232g/mol,设晶胞边长是a cm,则晶胞体积为![]() ,
, ![]() ,则a=
,则a=![]() 。
。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
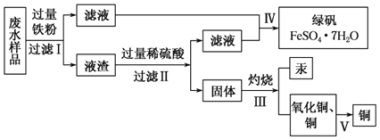
(1)步骤Ⅰ中加入过量铁粉的目的是_______________________________。
(2)步骤Ⅱ中________(填“能”或“不能”),用盐酸代替硫酸,写出步骤Ⅱ中涉及反应的化学方程式:____________________________________。
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩______________、______________、洗涤、干燥。现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是___________。
(4)步骤 V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案_________不好;从产品纯度考虑,方案_________不好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>②
A. abc B. bcd C. abcd D. acd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.硫酸的摩尔质量是98g
B.1mol N2的质量为28g/mol
C.摩尔是物质的量的单位
D.1mol氧的质量等于16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非典型肺炎是由病毒感染引起的。不少群众购买醋精用于室内消毒灭菌,这是因为醋精( )
A. 沸点低 B. 能使蛋白质变性
C. 有酸性 D. 具有医疗保健作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习。下列关于物质的类别中,不正确的是(括号内为类别)( )
A.H2O(氧化物)B.H2SO4(含氧酸)
C.CH3COOH(混合物)D.I2的CCl4溶液(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种硫酸溶液,一种物质的量浓度为C1mol/L,密度为ρ1g/cm3,另一种物质的量浓度为C2mol/L,密度为ρ2g/cm3,当它们等体积混合后,溶液的密度为ρ3g/cm3,则混合溶液的物质的量浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com