
【题目】下列叙述中,正确的是( )
A.硫酸的摩尔质量是98g
B.1mol N2的质量为28g/mol
C.摩尔是物质的量的单位
D.1mol氧的质量等于16g
科目:高中化学 来源: 题型:
【题目】以惰性电极电解下列物质的水溶液(电解质均过量),电解后溶液pH升高的是( )
①盐酸 ②硫酸 ③氢氧化钾 ④氯化钾 ⑤硝酸银 ⑥硫酸钠
A. ①②③ B. ④⑤⑥ C. ①③④ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在______ molAl2(SO4)3中含0.3 mol SO42–,含Al3+约_______________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为_________,密度之比为_________。
(3)质量同为46 g的两种气体,NO2和N2O4,物质的量之比为________,二者所含O原子个数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油产品A(C3H6)为主要原料,合成具有广泛用途的有机玻璃PMMA。流程如下(部分产物和条件省略)
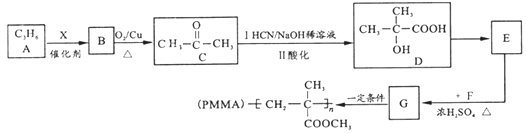
试回答下列问题:
(1)B的名称________;X试剂为_______(化学式);D中官能团名称_________。
(2)E→G的化学方程式为________________________________________,反应类型是_________。
(3)T是G的同分异构体,1molT与足量新制Cu(OH)2悬浊液反应最多生成2molCu2O沉淀,T的结构有________种(不含立体结构)。
(4)若高分子化合物PMMA的相对分子质量为1.5×106,其聚合度为_______。
(5)参照上述流程,以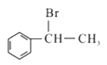 为原料合成
为原料合成 (其它原料自选)。设计合成路线:________________________。
(其它原料自选)。设计合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,由硫与氯气再50℃~60℃直接化合而成。装置图如下:

(1)二氯化二硫遇水会反应,生成硫、二氧化硫和刺鼻的酸雾,其化学方程式为______。
(2)A装置中所盛试剂为__________。
(3)操作过程中:
①先通入N2,理由是_________________。
②通入少量Cl2后,装置B采用________(填“水浴”或“油浴”)加热1h。
③停止加热,加大通入氯气量,维持16h。制备二氯化二硫为______(填“放热”或“吸热”)反应。
(4)二氯化二硫的电子式为______________。
(5)装置C的作用是__________,同时制得有价值的工业产品为___________。
(6)为了得到更纯净的二硫化二氯,需要在装置B、C之间安装干燥管,其内盛试剂为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
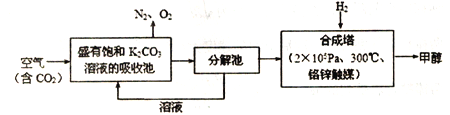
(1) 已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-94.9kJ/mol
CH3OH(g) ΔH1=-94.9kJ/mol
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
则在合成塔中,CO2与H2反应生成气态的H2O和甲醇的热化学方程式为_________.
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”( 写出一条即可)________.
(3)一定条件下,往2L 恒容密闭容器中充入1mol CO2 和3 mol H2,在不同催化剂作用下发生反应I、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的反应是__________(填“反应I”,“反应Ⅱ”,“反应Ⅲ”)。
②b点v (正)______ v (逆)(填“>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
④c点时该反应的平衡常数K =________。
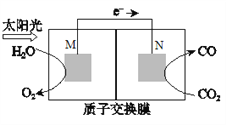
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为__________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mo/L,则生成沉淀所 需CaCl2溶液的最小浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
磷及其化合物是生活生产中重要的组成部分,以下是一些常见的磷的化合物:
(1)与磷同主族、比磷多一个周期的元素基态原子的价层电子排布为___________.
(2)磷与同周期相邻的两种元素的第一电离能由大到小的顺序为__________。(用元素符号表示)。
(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,请画出亚磷酸的分子结构_______。亚磷酸可作还原剂将Cu2+还原为单质,得到的电子填充到________轨道。
(4)己知PBr5晶体中存在PBr4+,和Br-两种离子,则PBr4+,中心P原子杂化类型为___,该离子的几何构型为______。而PCl5晶体中存在PCl4+和另一种阴离子,该阴离子配位数为6,请写出该离子的化学式:______。PBr5晶体中不能形成与PCl5晶体一样的阴离子的原因可能是:_________。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图,可以将其看做Si晶体的“广义等电子体”,可做半导体材料.
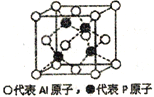
①根据“广义等电子原理”,下列物质中,可能是半导体的有____________.
A. SiC B.CaO2 C. GaAs D.Si3N4 E.BN
②磷化铝中,Al原子的配位数为_______,若该晶胞密度为dg/cm3,用NA表示阿伏伽德罗常数,则该晶体的边长为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为中符合安全要求的是( )
A.进入煤矿井时,用火把照明
B.实验时,将水倒入浓硫酸配制稀硫酸
C.用点燃的火柴在液化气钢瓶口检验是否漏气
D.节日期间,在开阔的广场燃放烟花爆竹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如下图所示。
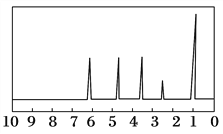
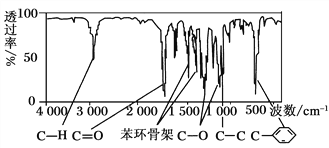
方法三:利用红外光谱仪测得A分子的红外光谱如上图所示。
请填空:
(1)A的分子式为________。
(2)A的分子中含一个甲基的依据是________。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(3)A的结构简式为________。
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基。则该类A的同分异构体共有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com