
如图所示表示的是电解饱和食盐水的装置,阴极材料、阳极材料都是碳棒,饱和食盐水中含有少量酚酞。
(1)接通电源后,饱和食盐水中的阳离子的移动方向是:向 极移动。
(2)电极上生成了气体A和B,生成气体A的电极反应式是 。
(3)随着气体的生成,饱和食盐水中产生了两种不同的颜色:一种是 色,其产生的位置是 (填“阴极区”或“阳极区”);另一种是 色,其产生的位置是 (填“阴极区”或“阳极区”)。
(1)阴极 (2)2H++2e-=H2↑ (3)浅黄绿 阳极区 红 阴极区
解析试题分析:(1)电解池中阳极失去电子发生氧化反应,阴极得到电子,发生还原反应,所以电解池中阳离子向阴极移动。根据装置图可知,接通电源后,饱和食盐水中的阳离子向阴极移动。
(2)A在阴极生成,所以是溶液中的氢离子在阴极放电生成氢气,电极反应式是2H++2e-=H2↑。
(3)阳极是氯离子放电,生成氯气。氯气溶于水得到氯水,氯水是浅黄绿色的。阴极氢离子放电,破坏阴极周围水的电离平衡,使阴极周围溶液显碱性,溶液显红色。
考点:考查电解饱和食盐水的有关判断
点评:该题基础性强,试题紧扣教材,侧重对学生基础知识的巩固和训练,难度不大。明确电解池的工作原理是答题的关键,注意水的电离平衡的特点和影响因素。


科目:高中化学 来源: 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 L。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外兴趣小组用下图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。
(1)以下叙述中,正确的是 (填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是 ,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。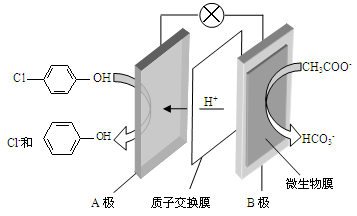
①B是电池的 极(填“正”或“负”);②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。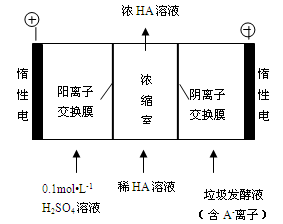
①阳极的电极反应式为 。
②简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。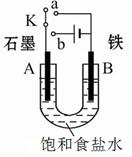
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。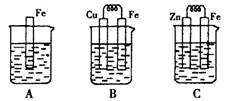
(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com