
����Ŀ�����н�����ʵ�ķ���ʽ����ȷ���ǣ� ��
A.��K3[Fe(CN)6]����Fe2+�����ӷ�Ӧ����ʽ��2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ��
B.�����������ȣ�ݵ�ԭ���Ƿ����ӻ���ǻ���ʯ��������ת�����ɷ���ʯ�����ӷ�Ӧ����ʽ��Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.��TiCl4�Ʊ�TiO2�Ļ�ѧ����ʽ��TiCl4+(x+2)H2O![]() TiO2��xH2O��+4HCl
TiO2��xH2O��+4HCl
D.��֪���ظ������Һ�д���������ƽ�⣺Cr2O72-+ H2O![]() H��+ 2CrO42-
H��+ 2CrO42-
���𰸡�D
��������
A. Fe2+����K3[Fe(CN)6]��������ɫ�����������ӷ�Ӧ����ʽ��2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ����A��ȷ��
B. ������������һ����Ԫ�أ�����ЧԤ��ȣ�ݣ�Ҳ����ЧԤ�������������ӻ����ǻ���ʯ��Ӧ���ɷ���ʯ�������ӷ�Ӧ����ʽ��Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH-��B��ȷ��
Ca5(PO4)3F +OH-��B��ȷ��
C. TiCl4��ˮ��Ӧ����TiO2���Ȼ��⣬�仯ѧ��Ӧ�ķ���ʽ��TiCl4+(x+2)H2O![]() TiO2��xH2O��+4HCl��C��ȷ��
TiO2��xH2O��+4HCl��C��ȷ��
D. �ظ������Һ�У��ظ������������Һ�п���ˮ��Ϊ��������ӣ������ӷ�Ӧ����ʽΪ��Cr2O72��+H2O![]() 2CrO42��+2H+��D����
2CrO42��+2H+��D����
�ʴ�Ϊ��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ�����ȷ����й㷺Ӧ�ã��о�����������Ҫ���塣
A��һ�ְ�ɫ���壬����ŨNaOH��Һ���ȣ��ų���ɫ����B����Բ����ƿ�ռ������B������ͼװ�ã�������ɫʯ����Һ���磬���Եõ���ɫ��Ȫ��A��ŨH2SO4��Ӧ���ų���ɫ����C����Բ����ƿ�ռ������C������ͼװ�ã�������ɫʯ����Һ���磬���Եõ���ɫ��Ȫ��

��1��д��A��ŨNaOH��Һ��������B�����ӷ���ʽ
_________________________________________________________��
��2�������ڳ�ȥB��ˮ�ֵĸ������______________��
�ռ�����C�ķ�����______________________________��
��3��������ɫʯ����Һ����IJ�����_____________________________________________��
��4����ͬ��ͬѹ�£���ͬ�����������ƿ�ֱ��������B������C������Ȫʵ���ˮ��������ƿ��������ƿ��������Һ�����ʵ���Ũ��֮����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ʣ���.Cu ��.NaCl���� ��.NaHSO4 ��.CO2 ��.CaO ��HCl ��.ϡH2SO4 ��. ����Ba(OH)2 ��.C2H5OH ��.NaCl��Һ��
���ڵ���ʵ��ǣ�����ţ���ͬ��_____�����ڷǵ���ʵ���_____���ܵ������______��
��2��д������������ˮ��Һ�еĵ��뷽��ʽ��
��NaHSO4 ___________________________��
��Al2(SO4)3 ________________________________��
��NH4NO3 ________________________��
��3����Ҫ��д�����з���ʽ��
��д������ͭ��Һ�еμ�����������Һ�ķ�Ӧ�����ӷ���ʽ��_____________��
��д���������ӷ���ʽCO32-��2H+��CO2����H2O��ʾ��һ����ѧ����ʽ��__________��
���𰸡��ڢۢݢޢ� �ܢ� �٢ߢ�� NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2�� Na2CO3+2HCl=2NaCl+CO2��+H2O����������
��������
��1����ˮ��Һ����ۻ�״̬���ܹ�������������ӵĻ������ǵ���ʣ����ڵ���ʵ���NaCl������NaHSO4��CaO��HCl������Ba(OH)2����ѡ�ڢۢݢޢࣻ��ˮ��Һ�������״̬�¶�����������������ӵĻ������Ƿǵ���ʣ����ڷǵ���ʵ���CO2��C2H5OH����ѡ�ܢ���������ƶ����ӻ����ӵ����ʿ��Ե��磬�ܵ������Cu��ϡH2SO4������Ba(OH)2��NaCl��Һ����ѡ�٢ߢ�⣻��2����NaHSO4��ˮ��Һ�еĵ��뷽��ʽΪNaHSO4=Na++H++SO42-����Al2(SO4)3��ˮ��Һ�еĵ��뷽��ʽΪAl2(SO4)3=2Al3++3SO42-����NH4NO3��ˮ��Һ�еĵ��뷽��ʽΪNH4NO3=NH4++NO3-����3��������ͭ��Һ�еμ�����������Һ����������ͭ�����������ƣ���Ӧ�����ӷ���ʽΪCu2++2OH-==Cu(OH)2�������������ӷ���ʽCO32-��2H+��CO2����H2O��ʾ��һ����ѧ����ʽ������Na2CO3+2HCl��2NaCl+CO2��+H2O��
�㾦����������ˮ��Һ�л������ۻ�ʱ�����ܷ�������������������ǵ���ʵ��������ݣ��ܷ�����ʵ�����ݡ�����ܵ�������ʲ�һ���ǵ���ʣ���ʯī������ʱ�����һ���ܵ��磬��NaCl���塣
�����͡������
��������
27
����Ŀ��Ϊ̽���������Ļ������һЩ��ѧ���ʣ�ijѧ��ʵ��С�����������ʵ�顣
��1����A��B��Һ�зֱ���뼸��KSCN��Һ����Һ����ɫA________��B____________��
��2��д�������������йط�Ӧ�Ļ�ѧ����ʽ��
Fe2O3��A_______________________��A��B____________________________��
��3��B��C�ɿ�����������___________________________________________��
��4����A�ı�����Һ�����ˮ�в����ϼ��ȣ����Ƶ�_______________���壻������ͨ���ý���ʱ���ɿ���һ�������ġ�ͨ·�������������Ϊ___________ЧӦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.0mol/LCuSO4��Һ��1.0mol/L H2SO4��Һ�������ϣ������Ϻ���Һ��������ڻ��ǰ������Һ�����֮�ͣ������Һ��CuSO4�����ʵ���Ũ��___��H2SO4�����ʵ���Ũ��___�����Һ��c��H+��___��c��Cu2+��___��c��SO42-��___������Һ�м����������ۣ������㹻����ʱ���������ʣ�ࡣ��ʱ��Һ��Fe2+�����ʵ���Ũ��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A.MgO(s)��C(s)=CO(g)��Mg(g)���������Է����У���÷�Ӧ��H��0����S��0
B.�����µ����ʵ���Ũ�ȵ�CH3COOH��Һ��HCl��Һ�У�ˮ�ĵ���̶���ͬ
C.0.1 mol��L��1 NH4Cl��Һ��ˮϡ�ͣ�![]() ��ֵ����
��ֵ����
D.���ڷ�Ӧ2SO2��O22SO3��ʹ�ô����ܼӿ췴Ӧ���ʲ����SO2��ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ʰ�����ˮ��Һ�н���������£�H3N+CH2COOH(A+)![]() H3N+CH2COO-(A��)
H3N+CH2COO-(A��)![]() H2NCH2COO-(A-)���ı���ҺpHֵ�����ָʰ���������ӵķֲ�����(����ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)�仯��ͼ��ʾ����������Һ��pHֵʹ�ʰ��������ľ����Ϊ�㣬��ʱ��Һ��pH�еȵ�㡣����˵����ȷ����( )
H2NCH2COO-(A-)���ı���ҺpHֵ�����ָʰ���������ӵķֲ�����(����ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)�仯��ͼ��ʾ����������Һ��pHֵʹ�ʰ��������ľ����Ϊ�㣬��ʱ��Һ��pH�еȵ�㡣����˵����ȷ����( )
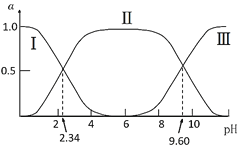
A.���ߢ�ֱ��������ΪA��A����A+
B.K2=102.34����K2��Ӧ�Ľ������Ϊ-NH3+
C.��pH=9.60����Һ�м����ᣬ��(A��)+��(A+)+��(A)���ֲ���
D.�ʰ���ĵȵ��pHԼΪ6���Ҵ���c(A��)=c(A+)=c(A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȩ�����ķ����кܶ࣬��������Ferrozine�������Ƚϸߡ��ⶨԭ��Ϊ��ȩ����������ԭ��Ag��������Ag��Fe3��������Ӧ����Fe2+��Fe2+������(Ferrozine)�γ���ɫ����ͨ���ⶨ����ȼ������ȩ�ĺ�����ijѧϰС����ȴ�ԭ���������װ�òⶨ��װ�����ڿ����м�ȩ�ĺ������г�װ����ȥ����

��֪����ȩ�ܱ�������Һ��������CO2������þ��ˮ��Ӧ�ų�NH3��ëϸ���ھ�������1 mm����ش��������⣺
(1)Aװ���з�Ӧ�Ļ�ѧ����ʽΪ___________���ñ���ʳ��ˮ����ˮ�Ʊ�NH3��ԭ����___________________��
(2)B��װ��AgNO3��Һ������B������Ϊ________��
(3)������Һ���Ʊ����ر�K1��K2����K3����______��ʹ����ʳ��ˮ��������Բ����ƿ�У����۲쵽B�а�ɫ����ǡ����ȫ�ܽ�ʱ��________��
(4)���ڿ����м�ȩ�����IJⶨ��
������ˮԡ����B����K1���������������������Ҷ˳鵽����ˣ�����1 L���ڿ������ر�K1������������______________�����ظ���������3�Ρ�ëϸ�ܵ�������__________��
��������B�г�ַ�Ӧ�����Һ�м���ϡ���������ҺpH=1���ټ�������Fe2(SO4)3��Һ����ַ�Ӧ�������������ຣ�Fe2���������γ���ɫ���ʣ���562 nm���ⶨ����ȣ��������Fe2+1.12 mg�������м�ȩ�ĺ���Ϊ____mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���ᱡ�ɴ���(![]() )���ܷ���ˮ�⡢��������ȥ��Ӧ
)���ܷ���ˮ�⡢��������ȥ��Ӧ
B. ��ȩ�ͱ�ϩȩ(![]() )����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
)����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
C. ���ۺ���ά�����������ȫˮ���IJ��ﶼ��������
D. CH3COOCH2CH3��CH3CH2COOCH3��Ϊͬ���칹�壬1H��NMR����ʾ���߾������ֲ�ͬ����ԭ����������ԭ�ӵı�����ͬ���ʲ�����1H��NMR������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ΪN��R2����������ΪA����ng����ͬ��̬�������������������ʵ���Ϊ�� ��
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.��A-N+2��molD.![]() (A-N+8)mol
(A-N+8)mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com