
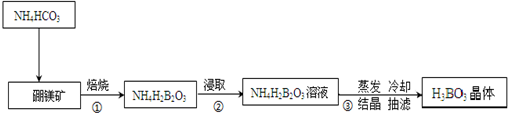
分析 由流程可知,硼镁矿与碳酸氢铵混合焙烧生成NH4H2BO3固体,再浸取得NH4H2BO3溶液,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3;
(1)硼镁矿焙烧时需在高温条件下,应在坩埚中进行;
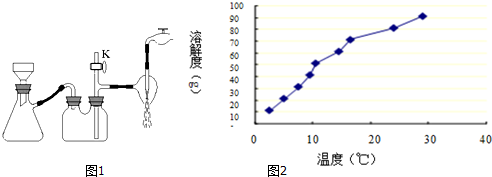
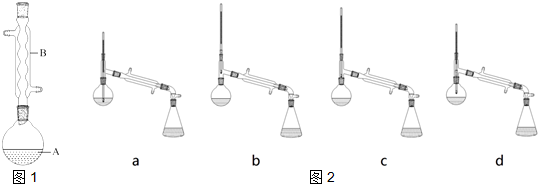
(2)压过滤时因压强减小过快产生倒吸,应采取最简单的实验操作是平衡内外压强,消除倒吸;浓度、结晶速率均影响结晶颗粒的大小;
(3)硼与铝为同族元素,具有相似的性质,且硼酸是极弱的一元弱酸,电离方程式为H3BO3?H++H2O+BO2-;由硼酸溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失;
(4)根据每1.00mlNaOH滴定液相当于30.92mg的H3BO3,用NaOH标准溶液滴定至15.80ml时到达终点进行计算.
解答 解:(1)因为焙烧为高温加热固体,所以步骤①中实验室需要把硼镁矿放在坩埚中进行焙烧,故答案为:坩埚;
(2)减压过滤时因压强减小过快产生倒吸,应采取最简单的实验操作是:打开旋塞K,平衡内外压强,消除倒吸;结晶时通常采用浓度较低,溶剂蒸发速度较慢或溶液冷却较慢的条件,可获得较大的晶体颗粒,故C正确;
故答案为:打开旋塞K; C;
(3)硼与铝为同族元素,具有相似的性质,且硼酸是极弱的一元弱酸,电离方程式为H3BO3?H++H2O+BO2-;根据硼酸的溶解度曲线,硼酸溶解度随着温度升高增大较快,则H3BO3晶体的洗涤过程中需要用冷水洗涤,以减少硼酸因溶解而损失;
故答案为:H3BO3?H++H2O+BO2-;冷水;硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
(4)每1.00mlNaOH滴定液相当于30.92mg的H3BO3,用NaOH标准溶液滴定至15.80ml时到达终点,则相当于30.92mg×15.8=488.536mg=0.488536gH3BO3,所以测该样品中H3BO3的质量分数为$\frac{0.488536g}{0.5000g}$×100%=97.71%;
故答案为:97.71%.
点评 本题考查了物质制备的流程分析判断,物质性质和实验过程判断,滴定实验的操作过程和计算应用,掌握基础是关键,题目难度中等.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
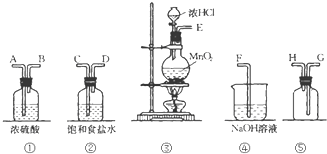 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学 | |
| B. | CO、H2CO3等含碳元素的化合物视作无机物的理由是他们的组成和性质跟无机物相似 | |
| C. | 迄今为止,人类发现和合成的有机物已超过3000万种 | |
| D. | 有机物受热不易分解,且不易燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E2F2 | B. | E2F3 | C. | EF3 | D. | EF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com