
【题目】下列物质中,含有共价键的离子晶体是( )
A.MgCl2
B.SO2
C.I2
D.NaOH
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
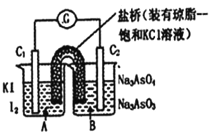
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
A.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作Ⅰ过程中,C1为正极
D.Ⅱ操作过程中,C1棒上发生的反应为:2I-_2e-=I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A. 第一块钠失去电子多 B. 两块钠的反应产物质量一样大
C. 第二块钠的反应产物质量大 D. 两块钠失去电子一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
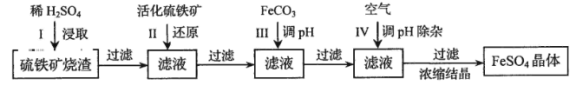
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) ![]() =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) ![]() =-393kJ/mol
=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ![]() =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________________池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:_______________________ (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通人到阴极室中,理由是_____________________。
②A口排出的是__________________(填“淡水”或“浓水”)。
(3)用苦卤(含 Na+、K+、Mg2+ Cl-、Br-等离子)可提取溴,其生产流程如下: 
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为:____________________.
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液?______________。
③向蒸馏塔中通人水蒸气加热,控制温度在90°C左右进行蒸馏的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=________
CO2(g)+H2(g)的平衡常数K2=________
(3)已知在1000 ℃时,该反应的平衡常数K3=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)在1 000 ℃下,从开始到20s时反应达到平衡状态,则CO浓度为____________mol/L,CO2的转化率为____________。此温度下,若某时刻CO2的物质的量为2 mol,则此时v正______________v逆(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年的诺贝尔化学奖授予以色列科学家阿龙·切哈诺夫、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节蛋白质水解。关于蛋白质的组成与性质的叙述正确的是
A. 蛋白质在酶的作用下水解的最终产物为氨基酸
B. 向蛋白质溶液中加入Na2SO4浓溶液,会使其变性
C. 天然蛋白质仅由碳、氢、氧、氮四种元素组成
D. 氨基酸和蛋白质都是只能和碱反应的酸性物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com