
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 粗颗粒大理石 | |
| ② | 常温 | 粗颗粒大理石 | 2.0 |
| ③ | | 粗颗粒大理石 | 2.0 |
| ④ | 常温 | | 2.0 |


科目:高中化学 来源:不详 题型:实验题
| 实验编号 | T/K | c(Na2S2O3)/ mol·L-1 | c(H2SO4)/ mol·L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响; 实验①和③探究反应物浓度对该反应速率的影响 |
| ② | 308 | | | |
| ③ | | 0.2 | |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管A中,加蒸馏水溶解。 | |
| 步骤2:向试管A加入 | |
| 步骤3:取步骤2的少量上层清液于试管B中, | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )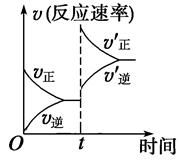
| A.①②③④ | B.①③ | C.①② | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
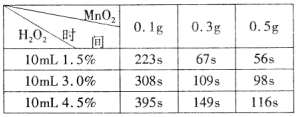
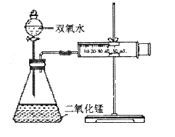
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验步骤 |
| A. | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B. | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.改用98%浓硫酸 | B.加热 |
| C.改用2mol/L硫酸 | D.把铁片换成铁粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 温度 | 浓度 | 催化剂 |
| A | 25℃ | 2mL5%H2O2 | 0.1mol/LFeCl32滴 |
| B | 35℃ | 2mL8%H2O2 | MnO2粉末 |
| C | 25℃ | 2mL5%H2O2 | MnO2粉末 |
| D | 25℃ | 2mL8%H2O2 | 0.1mol/LCuCl22滴 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 序号 | 金属质量 /g | 金属 状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com