
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
【答案】B
【解析】
A. 加入催化剂,反应速率加快,反应的活化能降低;
B. 升高温度,反应速率加快,平衡向吸热的方向移动;
C. 增大压强,平衡向体积缩小的方向移动;
D. 增大生成物的浓度,平衡移向移动。
A.加入催化剂,反应途径将发生改变,但根据盖斯定律反应的始态和终态不变,反应的ΔH不会改变,A项错误;
B.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,所以平衡正向移动,H2S分解率增大,B项正确;
C.该反应随反应进行气体分子数增多,增大压强,化学平衡逆向移动,由于正反应吸热,所以平衡逆向移动体系温度升高,C项错误;
D.恒容体系中充入H2平衡逆向移动,但平衡移动的趋势是很微弱的,只能减弱这种改变,不能抵消这种改变,因此再次平衡时H2的浓度比原来的大,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)2NO2(g),在其他条件相同时,测得实验数据如表:
压强/(×105 Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据分析,下列说法正确的是
A.增大压强,反应速率变慢
B.升高温度,反应速率加快
C.在8.0×105 Pa、30℃条件下,当转化率为98%时反应已达平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30℃条件下,转化率从50%增至90%时段NO的反应速率为4a/370 mol·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐。服用维生素C,有利于人体对铁元素的吸收。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作 用下转化成亚铁盐。此反应的离子方程式______。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
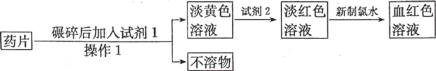
①操作1的名称是__________。
②试剂2为______溶液(填化学式)。
③加入新制氯水,溶液中发生反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )
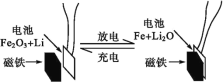
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电完成后,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
A.2 min 末时 A 和 B 的浓度之比为 5∶3
B.x=1
C.2 min 末时 A 消耗的浓度为 0.5 mol·L-1
D.2 min 末时 B 的浓度为 1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
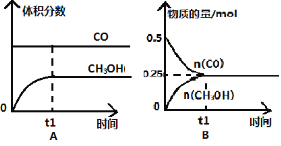
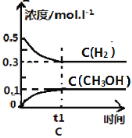

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是( )

A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.1molM与热的烧碱溶液反应,可消耗2molNaOH
C.B、C均能发生消去反应和酯化反应
D.A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com