
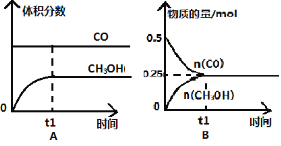
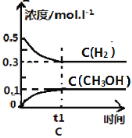
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】乙二酸(俗名草酸)广泛存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,但其钙盐难溶于水。其晶体(H2C2 O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
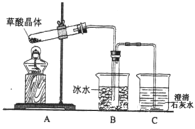
(1)某实验小组同学想通过实验探究草酸晶体的分解产物,设计了右图的装置,其中装置B的主要作用是_____________________。通过观察装置C中的__________________________现象,可以确定草酸晶体分解的产物中有_________________________________。
(2)另一组同学认为草酸晶体分解的产物中不可能只有CO2,从氧化还原反应知识的原理推测可能含有 CO,为了进验证此猜想,该组同学选用了实验中的装置 A、B 和下图所示的部分装置(可以重复选用)进行实验。
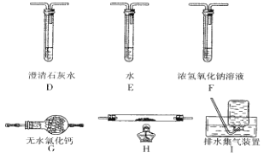
①该组同学的实验装置中,依次连接的合理顺序为 A、B、_______________。装置H反应管中盛有的物质是__________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
(3)设计实验证明草酸的酸性比碳酸的强___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某优质甜樱桃中含有一种羟基酸(用M表示),M的碳链结构无支链,分子式为C4H6O5;1.34 g M与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。M在一定条件下可发生如下转化:M![]() A
A![]() B
B![]() C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
A. M的结构简式为HOOC—CHOH—CH2—COOH
B. B的分子式为C4H4O4Br2
C. 与M的官能团种类、数量完全相同的同分异构体还有1种
D. C物质不可能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、
CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种离子为 (填化学式);1mol [Fe(CN)6]4-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为﹣20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成.已知小立方体如图所示.该合金的化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是________。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和 Fe的部分电离能数据如下表:

Mn元素价电子排布式为________,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难,其原因是___________________________。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于_______区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则 X的化学式为___________。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___________
②与CNO-互为等电子体微粒的化学式为__________(写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修2:化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸:

请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废渣减少
D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
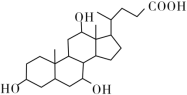
X(C24H40O5)
H2NCH2CH2CH2NHCH2CH2CH2CH2NH2 Y
下列叙述错误的是 ( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答以下问题:
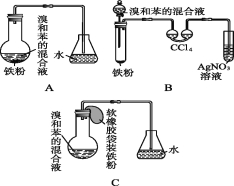
(1)写出三个装置中所共同发生的两个反应的化学方程式: 、 ;
(2)装置A和C均采用了长玻璃导管,其作用是 。
(3)B中采用了双球洗气管吸收装置,其作用是 ,反应后双球洗气管中可能出现的现象是 。
(4)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com