
����Ŀ���л��� A������ʳƷ��ҵ����֪ 9.0 g A ������ O2�г��ȼ�գ������ɵĻ����������ͨ��������Ũ����ͼ�ʯ�ң��ֱ����� 5.4g �� 13.2 g��������ʣ������Ϊ O2��
(1) A ���ӵ�����ͼ��ͼ��ʾ����ͼ�п�֪��Ħ��������_________���� A �ķ���ʽ��___________��

(2)A ���� NaHCO3 ��Һ������Ӧ���� A ���ӵĺ˴Ź���������4�����շ壬�����֮���� 1:1:1:3��A�к��еĹ�����������___________��
(3)д�� A ���ɾۺ���Ļ�ѧ����ʽ___________��
(4)�밴��ϵͳ������д���������� A ��ͬ��ͬ���칹�������___________��
���𰸡� 90g/mol C3H6O3 �ǻ����Ȼ� 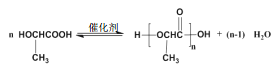 3-�ǻ�����
3-�ǻ�����
����������1��5.4gˮ�����ʵ���Ϊ![]() n��H��=0.6 mol��13.2g������̼�����ʵ���Ϊ
n��H��=0.6 mol��13.2g������̼�����ʵ���Ϊ![]() ��n��C��=n��CO2��=0.3 mol�����л���9.0g��OԪ��������9.0g-0.6g-0.3��12 g=4.8 g��n��O��=
��n��C��=n��CO2��=0.3 mol�����л���9.0g��OԪ��������9.0g-0.6g-0.3��12 g=4.8 g��n��O��=![]() ����n��C����n��H����n��O��=0.3mol��0.6mol��0.3mol=1��2��1����ʵ��ʽΪCH2O�������ʽΪ��CH2O��n��A����Է�������Ϊ90���ɵ�30n=90����ã�n=3�����л���AΪC3H6O3���ʴ�Ϊ��C3H6O3��
����n��C����n��H����n��O��=0.3mol��0.6mol��0.3mol=1��2��1����ʵ��ʽΪCH2O�������ʽΪ��CH2O��n��A����Է�������Ϊ90���ɵ�30n=90����ã�n=3�����л���AΪC3H6O3���ʴ�Ϊ��C3H6O3��
��2��A����NaHCO3��Һ������Ӧ��Aһ�������Ȼ���-COOH�����л���AΪC3H6O3���˴Ź���������4���壬�����֮����1��1��1��3���������4��Hԭ�ӵ���ĿΪ1��1��1��3�������к���1��-COOH��1��-CH3��1��![]() CH��1��-OH���л���A�Ľṹ��ʽΪCH3CH��OH��COOH���ʴ�Ϊ��CH3CH��OH��COOH�к��еĹ�����Ϊ�ǻ����Ȼ���
CH��1��-OH���л���A�Ľṹ��ʽΪCH3CH��OH��COOH���ʴ�Ϊ��CH3CH��OH��COOH�к��еĹ�����Ϊ�ǻ����Ȼ���
��3���л���A����-OH��-COOH���ۺϷ�Ӧ�õ������ķ�Ӧ����ʽΪ![]() ��(4)�밴��ϵͳ������д���������� A ��ͬ��ͬ���칹�������3-�ǻ�����.
��(4)�밴��ϵͳ������д���������� A ��ͬ��ͬ���칹�������3-�ǻ�����.


 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӹ�ҵ�� NF3 �������������ʴ�̼�����ҵ��ͨ����⺬ NH4F �ȵ���ˮ����������NF3������ԭ����ͼ������˵������ȷ���ǣ� ��

A. a �缫Ϊ���ص�����
B. �����ĵ缫��Ӧʽ�� NH4++3F--6e��===NF3+4H+
C. H+��b������a����������缫��Ӧ
D. �������п��ܻ����������������Լ�ǿ�����嵥�ʣ�������ķ���ʽΪ F2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���ɺ����������ʹ������(����)
��FeCl3����Fe2(SO4)3����Ca(HCO3)2����Na2CO3
A�����٢� B�����ڢ�
C�����٢� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ���ܴ�������, ������ҺΪ��ɫ������������ ( )
A. NH4+ ��Al3+��SO42- ��NO3- B. K+��Fe2+��NO3-��SO42-
C. K+��Cu2+��NH4+ ��Cl- D. Na+ ��K+��NO3- ��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹����F����һ�ֹ㷺Ӧ����ʳƷ�����ϡ��ǹ�����ζ������ṹʽΪ ���ϳɰ�˹�����һ�ֺϳ�·�����£�
���ϳɰ�˹�����һ�ֺϳ�·�����£�

��֪���ٷ����廯����A�ܷ���������Ӧ���˴Ź���������ʾ��5 �ֲ�ͬ��ѧ�������⡣
��
��RCN ![]() RCOOH
RCOOH
��
�ش��������⣺
��1��A ������Ϊ_________��E���еĹ�������_____________��
��2����Ӧ�ٵ�������_________����Ӧ�ݵ�������__________��
��3��C��D�Ľṹ��ʽ�ֱ���_______��_________��
��4��C��ͬ���칹������ͬʱ�������������Ĺ���________�֣������������칹����
�ٱ�����������ȡ����
������FeCl3 ��Һ��������ɫ
�����뱥��NaHCO3 ��Һ��Ӧ��������
��5�����������ϳ�·�ߣ����һ���ɼ�ȩΪ��ʼԭ���Ʊ���������ĺϳ�·�ߣ�___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������й�����������Һ��������ȷ����(������Һ���ʱ����仯)
�� | �� | �� | �� | |
pH | 12 | 12 | 2 | 2 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. ���٢��зֱ�����Ȼ�茶���������Һ��pHֵ������
B. �ֱ��������������ˮϡ��100����������Һ��pH����>��
C. ���٢�����Һ�������Ϻ�������Һ������
D. ����Һ������Һ��������������Ϻ�������ҺpH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϩ��(CH2=CHOH)���ȶ������Զ�ת��Ϊ��ȩ����Ԫ������ˮ���ɻ�״���������1mol�Ҷ�����һ����������ȥ1molH2O�����ò���Ľṹ��ʽ�����м��֣����в����ܵ���
��CH2=CH2 ��![]() ��CH3CHO ��
��CH3CHO ��![]() ��
��![]()
A. ֻ�Т� B. ֻ�Т٢� C. ֻ�Т٢� D. ֻ�Т٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ϲ�������������Ϊ����������Ⱦ�ĵ�������������Ӧ�ᳫ����
A. �ƹ�綯������������ɫ��ͨ
B. �ı����ʽ��Ԥ����������
C. ���յ�������������������
D. ������̬�Ļ���������ˮ��ɽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ũ��Ϊ0.1mol/L�ļ�����Һ��pH�����±��������й�˵����ȷ���ǣ� ��
���� | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. ͬ�¶�ͬŨ���£�����ǿ������˳��Ϊ��HF��H2CO3��HClO
B. ˮ�ⷽ��ʽ��F-+H2O![]() HF+OH-��ƽ�ⳣ��Ϊ1��10-13
HF+OH-��ƽ�ⳣ��Ϊ1��10-13
C. ��CO2ͨ��0.lmol/LNa2CO3��Һ����Һ�����ԣ�����Һ�У�2c(CO32-)+c(HCO3-)=0.1mol/L
D. �����ʵ�����NaF��HF�����Һ������Ũ�ȴ�С��ϵΪ��c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com